2023年8月29日,為及時研究并解決GB 9706.1-2020及配套并列標準�����、專用標準實施的重大技術問題�����,更好地發(fā)揮技術支撐作用,國家藥品監(jiān)督管理局醫(yī)療器械標準管理中心根據《國家藥品監(jiān)督管理局關于GB 9706.1-2020及配套并列標準�����、專用標準實施有關工作的通告》有關要求�����,制定并發(fā)布了《GB 9706.1-2020及配套并列標準�、專用標準專家咨詢機制》,詳見正文�。
2023年8月29日,為及時研究并解決GB 9706.1-2020及配套并列標準�、專用標準實施的重大技術問題,更好地發(fā)揮技術支撐作用�,國家藥品監(jiān)督管理局醫(yī)療器械標準管理中心根據《國家藥品監(jiān)督管理局關于GB 9706.1-2020及配套并列標準、專用標準實施有關工作的通告》有關要求�����,制定并發(fā)布了《GB 9706.1-2020及配套并列標準�����、專用標準專家咨詢機制》,詳見正文�。
GB 9706.1-2020及配套并列標準、專用標準專家咨詢機制
為及時研究并解決GB 9706.1-2020 及配套并列標準�、專用標準實施的重大技術問題,更好地發(fā)揮技術支撐作用�,統一對標準的理解和認識,規(guī)范執(zhí)行尺度�����,推進標準順利實施�,特制定本機制�����。
一�����、受理范圍
GB 9706.1-2020及配套并列標準�、專用標準實施過程中,藥品監(jiān)督管理部門�����、技術審查部門、醫(yī)療器械檢驗機構對標準內容理解存在差異等影響標準實施的重大技術問題�。
二、專家組成員單位
牽頭單位:中國食品藥品檢定研究院(國家藥品監(jiān)督管理局醫(yī)療器械標準管理中心)(以下簡稱器械標管中心)�����。
成員單位:中國食品藥品檢定研究院�����、國家藥品監(jiān)督管理局醫(yī)療器械技術審評中心�、相關標準歸口醫(yī)療器械標準化技術委員會。
根據咨詢所涉標準情況�,可增加有代表性產品的屬地藥品監(jiān)督管理部門以及屬地藥品監(jiān)督管理部門醫(yī)療器械技術審查部門、具有相關檢驗資質的醫(yī)療器械檢驗機構�����。
三�����、工作程序
(一)省級藥品監(jiān)督管理部門�、技術審查部門�����、醫(yī)療器械檢驗機構之間若對標準內容理解存在差異等影響標準實施的重大技術問題且無法協調一致的可書面向器械標管中心提交咨詢(提交內容和要求見附1)�����。
(二)器械標管中心根據咨詢事項涉及的標準�,組織標準歸口的醫(yī)療器械標準化技術委員會開展研究�����。技術委員會應及時和提出單位進行充分溝通�����,原則上應在15個工作日內提出處理意見�。若能形成一致意見�,由技術委員會對相關問題予以書面解答,視情況發(fā)布相關解釋性文件�,并將相關情況報送器械標管中心;若不能達成一致,技術委員會提出處理意見�����、報器械標管中心研究,是否啟動專家咨詢�����。
(三)若啟動專家咨詢�,器械標管中心將視情況組織咨詢會議,由專家組成員單位根據咨詢事項推薦1名專家代表本單位參加會議。
(四)會議由器械標管中心主持�����,如需要�,器械標管中心可于會議開始前指定專家組組長。會議原則上協商一致�,提出解決方案,形成專家會商意見�。若不能達成一致,進行投票表決�,超過半數的意見作為專家會商意見。.
(五)對影響標準全面實施的整體性�、共性問題,器械標管中心在專家會商意見的基礎上�,組織起草解釋性文件。國家標準的解釋報送國務院標準化行政主管部門發(fā)布;行業(yè)標準的解釋由國家藥品監(jiān)督管理局發(fā)布�。
四、附則
(一)本機制由器械標管中心負貴解釋�����。
(二)本機制自發(fā)布之日起實施。
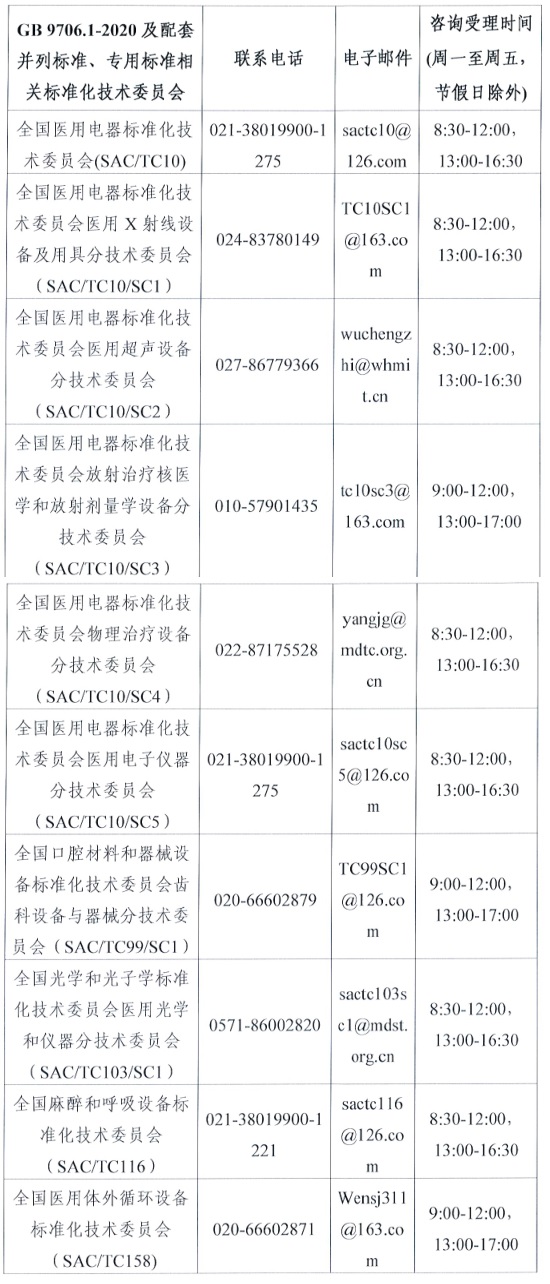
(三)關于GB 9706.1-2020 及配套并列標準�����、專用標準的具體技術問題�,可電話咨詢所涉標準歸口的醫(yī)療器械標準化技術委員會,聯系電話見附2�����。
附件1.GB9706.1-2020及配套并列標準�����、專用標準專家咨詢事項信息表

附件2.GB9706.1-2020及配套并列標準�、專用標準相關標準化技術委員會
更多有關GB9706.1-2020標準、可用性工程文檔編制服務等需求�����,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯絡�����,聯系人:葉工�,電話:18058734169,微信同�。