2024年10月18日�����,國家藥監(jiān)局發(fā)布眼用透明質(zhì)酸鈉����、膝關(guān)節(jié)翻修假體、醫(yī)用血管造影X射線系統(tǒng)�����、自動(dòng)加樣系統(tǒng)�����、合成可吸收性外科縫線5個(gè)進(jìn)口醫(yī)療器械注冊(cè)產(chǎn)品召回,一起來看具體情況�����。
2024年10月18日����,國家藥監(jiān)局發(fā)布眼用透明質(zhì)酸鈉、膝關(guān)節(jié)翻修假體����、醫(yī)用血管造影X射線系統(tǒng)、自動(dòng)加樣系統(tǒng)����、合成可吸收性外科縫線5個(gè)進(jìn)口醫(yī)療器械注冊(cè)產(chǎn)品召回,一起來看具體情況����。
一、愛惜康有限責(zé)任公司Ethicon LLC對(duì)合成可吸收性外科縫線主動(dòng)召回
強(qiáng)生(上海)醫(yī)療器材有限公司報(bào)告����,由于物料混淆導(dǎo)致部分包裝包含了錯(cuò)誤的縫針型號(hào)和縫線規(guī)格����,生產(chǎn)商愛惜康有限責(zé)任公司Ethicon LLC對(duì)其生產(chǎn)的合成可吸收性外科縫線MONOCRYL (Poliglecaprone 25) Monofilament Synthetic Absorbable Suture(國械注進(jìn)20193022157)主動(dòng)召回�����。召回級(jí)別為二級(jí)召回����。本次召回涉及產(chǎn)品未進(jìn)口至中國,具體型號(hào)����、規(guī)格及批次等詳細(xì)信息見《醫(yī)療器械召回事件報(bào)告表》。

二�����、貝克曼庫爾特(美國)股份有限公司Beckman Coulter, Inc. 對(duì)自動(dòng)加樣系統(tǒng)主動(dòng)召回
貝克曼庫爾特國際貿(mào)易(上海)有限公司報(bào)告�����,由于軟件缺陷原因����,生產(chǎn)商貝克曼庫爾特(美國)股份有限公司Beckman Coulter, Inc.對(duì)其生產(chǎn)的自動(dòng)加樣系統(tǒng)CellMek SPS(國械備20230484)主動(dòng)召回�����。召回級(jí)別為三級(jí)召回�����。本次召回涉及產(chǎn)品未進(jìn)口至中國,具體型號(hào)�����、規(guī)格及批次等詳細(xì)信息見《醫(yī)療器械召回事件報(bào)告表》�����。

三����、飛利浦醫(yī)療系統(tǒng)荷蘭有限公司Philips Medical Systems Nederland B.V對(duì)醫(yī)用血管造影X射線系統(tǒng)等產(chǎn)品主動(dòng)召回
飛利浦(中國)投資有限公司報(bào)告�����,由于發(fā)現(xiàn)產(chǎn)品使用說明書和技術(shù)文檔的技術(shù)數(shù)據(jù)不一致�����,生產(chǎn)商飛利浦醫(yī)療系統(tǒng)荷蘭有限公司Philips Medical Systems Nederland B.V對(duì)其生產(chǎn)的醫(yī)用血管造影X射線系統(tǒng)Medical Angiography X-ray System(國械注進(jìn)20203060323、國械注進(jìn)20193060314����、國械注進(jìn)20193060315、國械注進(jìn)20193060317�����、國械注進(jìn)20193060319����、國械注進(jìn)20203060268����、國械注進(jìn)20223060150、國械注進(jìn)20223060257)主動(dòng)召回����。召回級(jí)別為三級(jí)召回。本次召回涉及產(chǎn)品未進(jìn)口至中國,具體產(chǎn)品的型號(hào)�����、規(guī)格及批次等詳細(xì)信息見《醫(yī)療器械召回事件報(bào)告表》����。

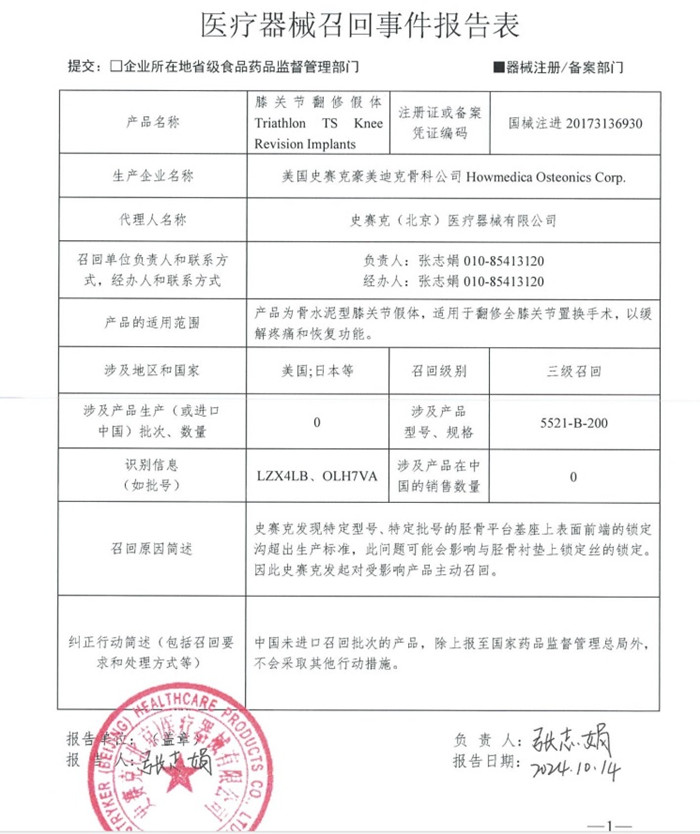
四����、美國史賽克豪美迪克骨科公司 Howmedica Osteonics Corp. 對(duì)膝關(guān)節(jié)翻修假體主動(dòng)召回
史賽克(北京)醫(yī)療器械有限公司報(bào)告�����,由于發(fā)現(xiàn)脛骨平臺(tái)基座上表面前端的鎖定溝超出生產(chǎn)標(biāo)準(zhǔn)�����,生產(chǎn)商美國史賽克豪美迪克骨科公司 Howmedica Osteonics Corp. 對(duì)其生產(chǎn)的膝關(guān)節(jié)翻修假體Triathlon TS Knee Revision Implants(國械注進(jìn)20173136930)主動(dòng)召回�����。本次召回涉及的產(chǎn)品未進(jìn)口至中國����,具體型號(hào)、規(guī)格及批次等詳細(xì)信息見《醫(yī)療器械召回事件報(bào)告表》����。
五、海奧技術(shù)有限公司Hyaltech Ltd.對(duì)眼用透明質(zhì)酸鈉主動(dòng)召回
卡爾蔡司(上海)管理有限公司報(bào)告�����,由于發(fā)現(xiàn)產(chǎn)品泡罩存在破洞缺陷,生產(chǎn)商海奧技術(shù)有限公司Hyaltech Ltd.對(duì)其生產(chǎn)的眼用透明質(zhì)酸鈉Z-Hyalin Plus Viscoelastic solution for use in intraocular surgery(國械注進(jìn)20193162441)主動(dòng)召回�����。召回級(jí)別為二級(jí)召回����。本次召回涉及產(chǎn)品未進(jìn)口至中國,具體型號(hào)、規(guī)格及批次等詳細(xì)信息見《醫(yī)療器械召回事件報(bào)告表》����。

如有進(jìn)口醫(yī)療器械注冊(cè)代理服務(wù)需求�����,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)�����,聯(lián)系人:葉工�����,電話:18058734169,微信同�����。