2023年12月20日���,通用�、美敦力��、史賽克����、奧利巴斯等九家公司召回醫(yī)療器械注冊產(chǎn)品,一起來看具體涉及哪些產(chǎn)品���。
2023年12月20日�����,通用����、美敦力����、史賽克、奧利巴斯等九家公司召回醫(yī)療器械注冊產(chǎn)品����,一起來看具體涉及哪些產(chǎn)品。
一���、通用電氣醫(yī)療公司GE Healthcare對影像歸檔及傳輸軟件主動召回
通用電氣醫(yī)療系統(tǒng)貿(mào)易發(fā)展(上海)有限公司報告��,由于涉事產(chǎn)品在Workflow Manager(工作流管理器)和Universal Viewer(通用查看器)可能無法關(guān)閉上一檢查數(shù)據(jù)的問題���。生產(chǎn)商通用電氣醫(yī)療公司GE Healthcare對其生產(chǎn)的影像歸檔及傳輸軟件(國械注進20182701756)主動召回�。召回級別為二級召回�。涉及產(chǎn)品的型號、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》���。

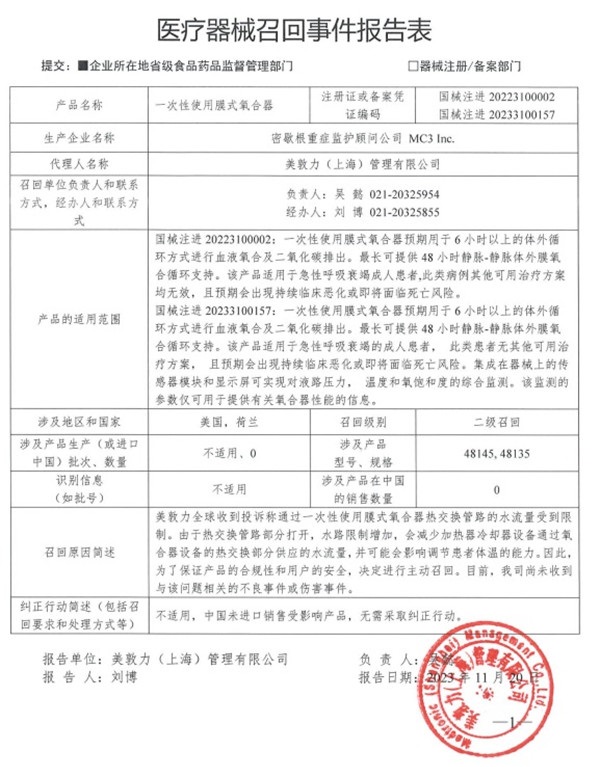
二�、密歇根重癥監(jiān)護顧問公司 MC3 Inc.對一次性使用膜式氧合器主動召回
美敦力(上海)管理有限公司報告���,由于一次性使用膜式氧合器熱交換管路的水流量受到限制,這會影響調(diào)節(jié)患者體溫能力等原因����,生產(chǎn)商密歇根重癥監(jiān)護顧問公司MC3 Inc.對其生產(chǎn)的一次性使用膜式氧合器Nautilus ECMO Oxygenator(國械注進20223100002)、一次性使用膜式氧合器Nautilus Smart ECMO Module(國械注進20233100157)主動召回�����。召回級別為二級召回����。涉及產(chǎn)品的型號�、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》�����。
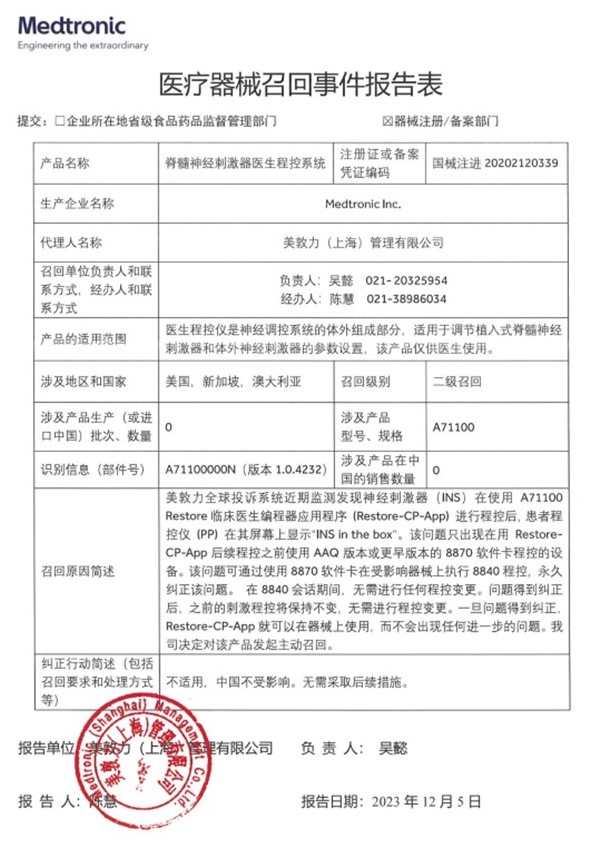
三�����、美敦力公司Medtronic Inc.對脊髓神經(jīng)刺激器醫(yī)生程控系統(tǒng)主動召回
美敦力(上海)管理有限公司報告��,由于近期發(fā)現(xiàn)神經(jīng)刺激器(INS)在使用 A71100 Restore臨床醫(yī)生編程器應(yīng)用程序 (Restore-CP-App) 進行程控后�,會導(dǎo)致患者程控儀 (PP) 在其屏幕上顯示“INS in the box”的問題。生產(chǎn)商美敦力公司Medtronic Inc.對其生產(chǎn)的脊髓神經(jīng)刺激器醫(yī)生程控系統(tǒng)(國械注進20202120339)主動召回�。召回級別為二級召回。涉及產(chǎn)品的型號�、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》。
四����、柯惠有限責任公司Covidien llc對可吸收釘修補固定器主動召回
柯惠醫(yī)療器材國際貿(mào)易(上海)有限公司報告,由于涉事產(chǎn)品制造錯誤導(dǎo)致鋁箔袋側(cè)邊密封強度低�����,可能導(dǎo)致無菌/防潮屏障破裂的原因。生產(chǎn)商柯惠有限責任公司Covidien llc對其生產(chǎn)的可吸收釘修補固定器(國械注進20173130196)主動召回��。召回級別為二級召回�����。

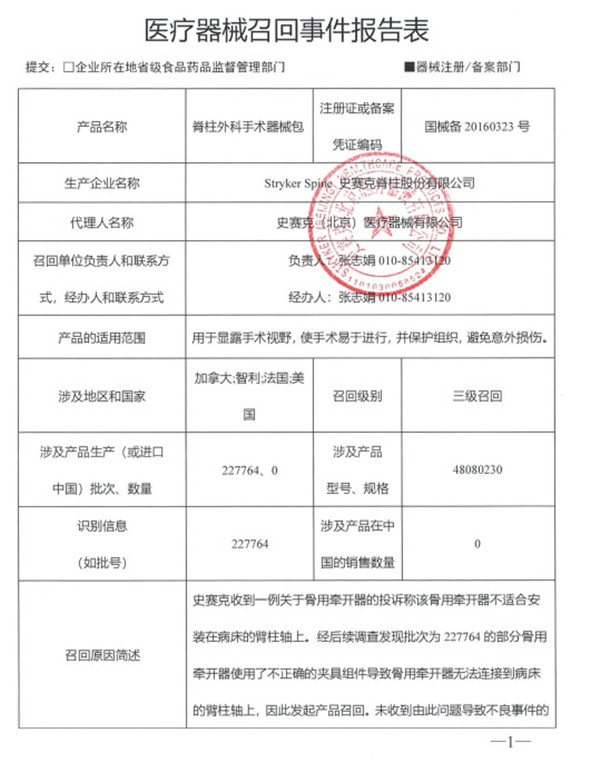
五�、史賽克脊柱股份有限公司Stryker Spine對脊柱外科手術(shù)器械包主動召回
史賽克(北京)醫(yī)療器械有限公司報告,由于特定型號特定批次的骨用牽開器使用了不正確的夾具組件導(dǎo)致骨用牽開器無法連接到病床的臂柱軸上��,生產(chǎn)商史賽克脊柱股份有限公司Stryker Spine對其生產(chǎn)的脊柱外科手術(shù)器械包Spine Instruments(國械備20160323號)主動召回��。召回級別為三級召回���。涉及產(chǎn)品的型號��、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》�。
六����、碧迪醫(yī)療公司Becton Dickinson Medical(S)Pte.Ltd.對一次性使用無菌注射器帶/不帶注射針主動召回
碧迪醫(yī)療器械(上海)有限公司報告����,由于注射器筒內(nèi)的流體路徑中存在昆蟲問題�����,生產(chǎn)商碧迪醫(yī)療公司Becton Dickinson Medical (S) Pte.Ltd.對其生產(chǎn)的一次性使用無菌注射器帶/不帶注射針Hypodermic syringes with/without needle(國械注進20193141832)主動召回���。召回級別為三級召回。涉及產(chǎn)品的型號���、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》�。

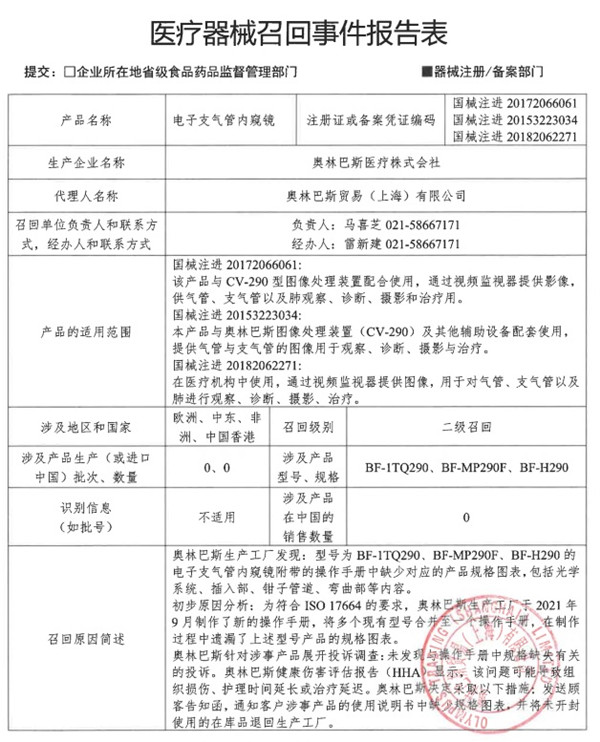
七�、奧林巴斯醫(yī)療株式會社對電子支氣管內(nèi)窺鏡主動召回
奧林巴斯貿(mào)易(上海)有限公司報告,由于涉事產(chǎn)品操作手冊中缺少產(chǎn)品規(guī)格圖表等原因����,生產(chǎn)商奧林巴斯醫(yī)療株式會社對其生產(chǎn)的電子支氣管內(nèi)窺鏡(國械注進20153223034、國械注進20172066061��、國械注進20182062271)主動召回���。召回級別為二級召回���。涉及產(chǎn)品的型號、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》。
八���、史賽克神經(jīng)介入公司Stryker Neurovascular對微導(dǎo)管主動召回
史賽克(北京)醫(yī)療器械有限公司報告����,由于部分配置的Trevo微導(dǎo)管產(chǎn)品批次被錯誤發(fā)往美國客戶����,生產(chǎn)商史賽克神經(jīng)介入公司Stryker Neurovascular對其生產(chǎn)的微導(dǎo)管(國械注進20153033916、國械注進20223030396)主動召回��。召回級別為三級召回���。涉及產(chǎn)品的型號��、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》����。本次召回不影響中國����。

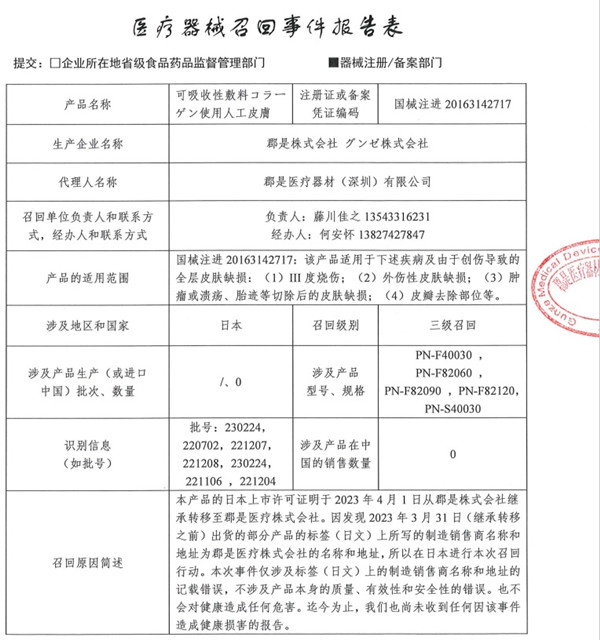
九、郡是醫(yī)療株式會社對可吸收性敷料使用人工皮膚主動召回
郡是醫(yī)療器材(深圳)有限公司報告���,由于境外的說明書標簽錯誤原因���,生產(chǎn)商郡是醫(yī)療株式會社對其生產(chǎn)的可吸收性敷料使用人工皮膚(國械注進20163142717)主動召回。召回級別為三級召回�。涉及產(chǎn)品的型號、規(guī)格及批次等詳細信息見《醫(yī)療器械召回事件報告表》�。