按照馬來西亞《醫(yī)療器械管理法》規(guī)定�����,所有在馬來西亞生產(chǎn)�����、進口的醫(yī)療器械產(chǎn)品都必須在醫(yī)療器械管理局進行醫(yī)療器械注冊后方可進入市場�����。對于進口的醫(yī)療器械生產(chǎn)商而言�����,需找到授權代理(authorized represetative�����,AR)完成注冊事宜�����。馬來西亞醫(yī)療器械監(jiān)管的主管部門為衛(wèi)生部下屬的醫(yī)療器械管理局(Medical Device Athority�����,MDA)�����。
引言:按照馬來西亞《醫(yī)療器械管理法》規(guī)定�����,所有在馬來西亞生產(chǎn)、進口的醫(yī)療器械產(chǎn)品都必須在醫(yī)療器械管理局進行醫(yī)療器械注冊后方可進入市場�����。對于進口的醫(yī)療器械生產(chǎn)商而言�����,需找到授權代理(authorized represetative�����,AR)完成注冊事宜�����。馬來西亞醫(yī)療器械監(jiān)管的主管部門為衛(wèi)生部下屬的醫(yī)療器械管理局(Medical Device Athority�����,MDA)�����。

馬來西亞醫(yī)療器械管理局主要職責范圍是:責成醫(yī)療器械廠商(本國或外國)嚴格遵守《醫(yī)療器械質(zhì)量管理體系》(ISO13485)的質(zhì)量體系要求�����;指導廠商進行創(chuàng)新產(chǎn)品的臨床試驗�����;對本國及進口的醫(yī)療器械產(chǎn)品進行注冊及疏通醫(yī)療器械國內(nèi)銷售渠道�����。
一�����、馬拉西亞醫(yī)療器械分類:
在馬來西亞�����,醫(yī)療器械是指制造商為診斷�����、預防�����、監(jiān)測、治療或減輕疾病或傷害而打算單獨或組合用于人類的任何儀器�����、器械�����、工具�����、機器�����、器具�����、植入物�����、體外試劑或校準器�����、軟件�����、材料或其他類似或相關物品�����。
馬拉西亞醫(yī)療器械注冊程序和準則嚴格遵循東盟醫(yī)療設備指令(AMDD)標準�����。器械被分為A�����、B�����、C�����、D四類,從低風險分類到高風險分類排序�����。此外�����,還有第五類為組合器械�����。注冊途徑根據(jù)設備的分類而有所不同�����。
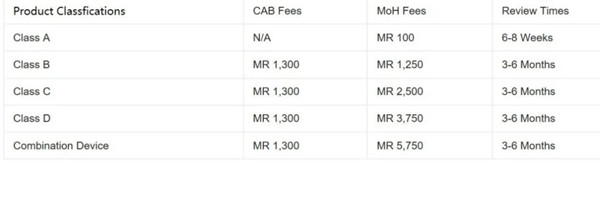
二�����、馬來西亞醫(yī)療器械注冊證書轉(zhuǎn)讓:醫(yī)療器械注冊申請必須通過在線MEDCAST系統(tǒng)提交�����,由獲得許可的當?shù)貙嶓w公司同時作為License Holder�����,或Malaysia Authorized Holder(MAH)�����。許可證可以從一個授權代表(Authorized Representative�����,簡稱AR)轉(zhuǎn)移到另一個�����。新的AR將在衛(wèi)生部MEDCAST在線門戶網(wǎng)站上填寫一份申請�����。所需文件包括現(xiàn)任AR申報表(Annex B – MDA/GD0041)�����、終止信和新AR的授權信�����。衛(wèi)生部對每個醫(yī)療器械注冊ID收取約500馬幣(115美元)。更多有關馬拉西亞醫(yī)療器械注冊服務需求�����,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡�����,聯(lián)系人:葉工�����,電話:18058734169�����,微信同�����。