對(duì)醫(yī)療器械CE認(rèn)證而言�,制造商及其義務(wù)是最核心的事項(xiàng)�。多數(shù)企業(yè)首次接觸醫(yī)療器械CE認(rèn)證�,多是第三方機(jī)構(gòu)代辦,加上I類自我宣稱方式�,企業(yè)其應(yīng)有的責(zé)任和義務(wù)往往疏于了解,而這些內(nèi)容對(duì)企業(yè)經(jīng)營(yíng)風(fēng)險(xiǎn)防控又極其重要�。
引言:對(duì)醫(yī)療器械CE認(rèn)證而言,制造商及其義務(wù)是最核心的事項(xiàng)�。多數(shù)企業(yè)首次接觸醫(yī)療器械CE認(rèn)證,多是第三方機(jī)構(gòu)代辦�,加上I類自我宣稱方式�,企業(yè)其應(yīng)有的責(zé)任和義務(wù)往往疏于了解,而這些內(nèi)容對(duì)企業(yè)經(jīng)營(yíng)風(fēng)險(xiǎn)防控又極其重要�。
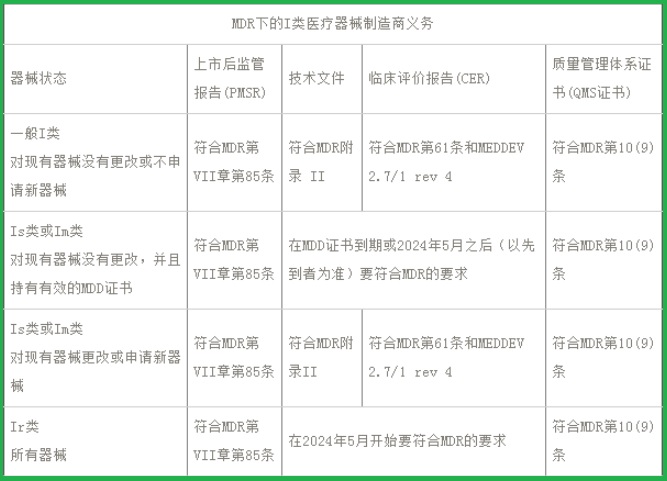
I類醫(yī)療器械CE認(rèn)證(MDR)之制造商義務(wù):
(一)I類器械的PMSR
如果您是I類器械的制造商,即使您不打算在短期內(nèi)對(duì)I類器械做任何變更�,并將繼續(xù)聲明符合MDD,您也需要按照歐盟MDR第85條的規(guī)定�,建立PMS計(jì)劃和生成PMSR報(bào)告。PMSR要包括器械的整個(gè)生命周期�,需要總結(jié)PMS數(shù)據(jù)的結(jié)果和結(jié)論,以及對(duì)市場(chǎng)上產(chǎn)品采取的任何糾正措施的依據(jù)和說(shuō)明�。必要時(shí),應(yīng)對(duì)該報(bào)告進(jìn)行更新�,且如果主管當(dāng)局要求應(yīng)及時(shí)提供。
(二)I類器械的技術(shù)文件
MDR的附錄II要求所有醫(yī)療器械制造商都建立完整的技術(shù)文件�,其中包括申報(bào)產(chǎn)品�、前代產(chǎn)品和類似產(chǎn)品的詳細(xì)信息�,申報(bào)產(chǎn)品的完整標(biāo)簽信息,設(shè)計(jì)和制造信息�,基本安全和性能要求,收益風(fēng)險(xiǎn)分析和風(fēng)險(xiǎn)管理信息�,產(chǎn)品驗(yàn)證和確認(rèn)數(shù)據(jù),臨床數(shù)據(jù)等�。
如果對(duì)I類無(wú)菌和I類帶測(cè)量功能器械不進(jìn)行任何變更并且仍持有有效的MDD證書,則暫時(shí)無(wú)需按照MDR更新技術(shù)文件�,所有通過(guò)自我宣稱途徑的可重復(fù)使用的手術(shù)器械也是如此。但是�,如果您要銷售任何新的I類器械,或者對(duì)已有器械的設(shè)計(jì)或預(yù)期用途進(jìn)行變更�,則必須按照MDR附錄II的要求建立技術(shù)文件。
(三)I類器械的CER
如果是I類無(wú)菌和I類帶測(cè)量功能的器械�,您可能已經(jīng)具有符合MDD的技術(shù)文件。但是根據(jù)通常情況�,MDD下I類醫(yī)療器械的CER基本不會(huì)符合MDR的要求。公告機(jī)構(gòu)可能不會(huì)接受單純的歷史數(shù)據(jù)�,尤其僅僅是沒(méi)有不良事件的歷史數(shù)據(jù)。所以現(xiàn)在就要開(kāi)始計(jì)劃“主動(dòng)”的收集臨床數(shù)據(jù)為將來(lái)做好準(zhǔn)備�。
(四)I類制造商的QMS
ISO 13485:2016質(zhì)量體系標(biāo)準(zhǔn)目前在中國(guó)貫徹的還是比較好的,還是有很多I類自我宣稱的醫(yī)療器械生產(chǎn)商都按照該標(biāo)準(zhǔn)建立了質(zhì)量管理體系且都獲得了認(rèn)證�。如果您的企業(yè)還沒(méi)有的話,那我們建議您要抓緊時(shí)間了�。MDR第10條明確提出了企業(yè)建立質(zhì)量管理體系的要求�,且獲得ISO13485證書是最簡(jiǎn)單的證明符合法規(guī)的方式�。在建立質(zhì)量管理體系的時(shí)候不要忘記MDR的法規(guī)要求,包括但不僅限于制定法規(guī)符合性負(fù)責(zé)人�,建立警戒系統(tǒng)程序等。
(五)在EUDAMED中注冊(cè)您的公司
歐盟委員會(huì)于2020年12月開(kāi)放了EUDAMED在線數(shù)據(jù)庫(kù)�,您需要在EUDAMED數(shù)據(jù)庫(kù)中注冊(cè)您的公司和器械。即使您不提交新的MDR注冊(cè)�,最好也是先獲得單一注冊(cè)號(hào)(SRN),并熟悉該系統(tǒng)�,因?yàn)楹罄m(xù)的證書和符合性聲明都需要列明SRN。