甘肅下轄12個(gè)地級(jí)市、2個(gè)自治州���,是西北地區(qū)經(jīng)濟(jì)和政治中心之一����,也有非常好的醫(yī)療產(chǎn)業(yè)基礎(chǔ),正好因?yàn)楣ぷ鞒霾畹礁拭C武威����,寫(xiě)個(gè)文章為大家科普有關(guān)甘肅第二類(lèi)醫(yī)療器械產(chǎn)品注冊(cè)流程?和要求。
甘肅下轄12個(gè)地級(jí)市��、2個(gè)自治州���,是西北地區(qū)經(jīng)濟(jì)和政治中心之一,也有非常好的醫(yī)療產(chǎn)業(yè)基礎(chǔ)�,正好因?yàn)楣ぷ鞒霾畹礁拭C武威,寫(xiě)個(gè)文章為大家科普有關(guān)甘肅第二類(lèi)醫(yī)療器械產(chǎn)品注冊(cè)流程和要求�����。
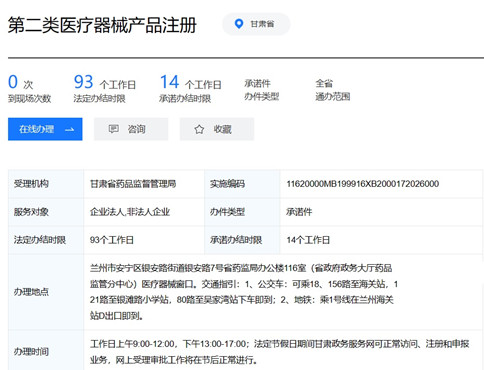
一�����、甘肅第二類(lèi)醫(yī)療器械產(chǎn)品注冊(cè)要多少時(shí)間��?
1��、受理之日起�,3個(gè)工作日內(nèi)將申報(bào)資料轉(zhuǎn)交技術(shù)審評(píng)機(jī)構(gòu)��;60個(gè)工作日內(nèi)完成第二類(lèi)醫(yī)療器械注冊(cè)的技術(shù)審評(píng)工作�;技術(shù)審評(píng)結(jié)束后20個(gè)工作日內(nèi)作出決定�;10個(gè)工作日內(nèi)發(fā)給醫(yī)療器械注冊(cè)證。
2��、技術(shù)審評(píng)過(guò)程中需要申請(qǐng)人補(bǔ)正資料的���,申請(qǐng)人應(yīng)當(dāng)在1年內(nèi)按照補(bǔ)正通知的要求一次提供補(bǔ)充資料�����;技術(shù)審評(píng)機(jī)構(gòu)應(yīng)當(dāng)自收到補(bǔ)充資料之日起60個(gè)工作日內(nèi)完成技術(shù)審評(píng)�����。申請(qǐng)人補(bǔ)充資料的時(shí)間不計(jì)算在審評(píng)時(shí)限內(nèi)�����。
二����、甘肅第二類(lèi)醫(yī)療器械產(chǎn)品注冊(cè)受理?xiàng)l件:
1���、醫(yī)療器械注冊(cè)應(yīng)遵守相關(guān)法律���、法規(guī)�、規(guī)章��、強(qiáng)制性標(biāo)準(zhǔn)�,遵循醫(yī)療器械安全和性能基本原則,參照相關(guān)技術(shù)指導(dǎo)原則�����,證明注冊(cè)�����、備案的醫(yī)療器械安全����、有效��、質(zhì)量可控�����,保證全過(guò)程信息真實(shí)、準(zhǔn)確�、完整和可追溯。
2��、申請(qǐng)人�、備案人應(yīng)當(dāng)為能夠承擔(dān)相應(yīng)法律責(zé)任的企業(yè)或者研制機(jī)構(gòu)。
3�、申請(qǐng)人、備案人應(yīng)當(dāng)建立與產(chǎn)品相適應(yīng)的質(zhì)量管理體系���,并保持有效運(yùn)行��。
4���、辦理醫(yī)療器械注冊(cè)、備案事項(xiàng)的人員應(yīng)當(dāng)具有相應(yīng)的專(zhuān)業(yè)知識(shí)��,熟悉醫(yī)療器械注冊(cè)����、備案管理的法律、法規(guī)����、規(guī)章和注冊(cè)管理相關(guān)規(guī)定��。
5�、申請(qǐng)注冊(cè)��,應(yīng)按照國(guó)家藥品監(jiān)督管理局有關(guān)注冊(cè)的要求提交相關(guān)資料���,申請(qǐng)人�����、備案人對(duì)資料的真實(shí)性負(fù)責(zé)���。
6�����、注冊(cè)資料應(yīng)當(dāng)使用中文����。根據(jù)外文資料翻譯的,應(yīng)當(dāng)同時(shí)提供原文���。引用未公開(kāi)發(fā)表的文獻(xiàn)資料時(shí)�����,應(yīng)當(dāng)提供資料權(quán)利人許可使用的文件����。
7、醫(yī)療器械應(yīng)當(dāng)符合適用的強(qiáng)制性標(biāo)準(zhǔn)�����。產(chǎn)品結(jié)構(gòu)特征��、預(yù)期用途��、使用方式等與強(qiáng)制性標(biāo)準(zhǔn)的適用范圍不一致的���,申請(qǐng)人�����、備案人應(yīng)當(dāng)提出不適用強(qiáng)制性標(biāo)準(zhǔn)的說(shuō)明����,并提供相關(guān)資料。
8�、 醫(yī)療器械注冊(cè)應(yīng)遵循醫(yī)療器械分類(lèi)規(guī)則和分類(lèi)目錄的有關(guān)要求。
三�、甘肅第二類(lèi)醫(yī)療器械產(chǎn)品注冊(cè)流程:
第二類(lèi)醫(yī)療器械產(chǎn)品注冊(cè)流程圖如下:
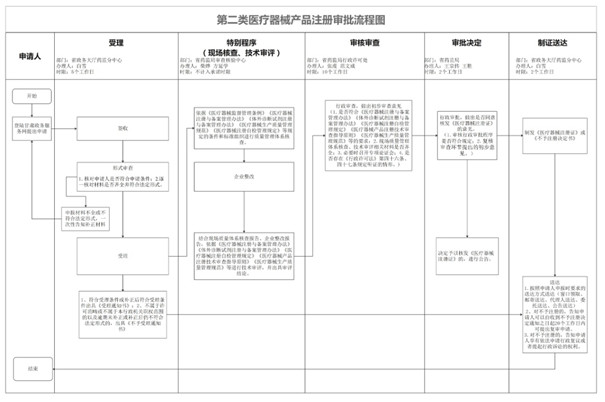
除流程圖上所示事項(xiàng)之外,企業(yè)還需要預(yù)算準(zhǔn)備第二類(lèi)醫(yī)療器械注冊(cè)申報(bào)材料的時(shí)間�。