《藥品管理法》第七十六條規(guī)定:醫(yī)療機(jī)構(gòu)配制的制劑�,應(yīng)當(dāng)是本單位臨床需要而市場(chǎng)上沒有供應(yīng)的品種�,并應(yīng)當(dāng)經(jīng)所在地省、自治區(qū)�、直轄市人民政府藥品監(jiān)督管理部門批準(zhǔn);但是�,法律對(duì)配制中藥制劑另有規(guī)定的除外�。醫(yī)療機(jī)構(gòu)配制的制劑應(yīng)當(dāng)按照規(guī)定進(jìn)行質(zhì)量檢驗(yàn)�;合格的,憑醫(yī)師處方在本單位使用�。本文為大家介紹甘肅醫(yī)療機(jī)構(gòu)制劑注冊(cè)流程和要求。
《中華人民共和國(guó)藥品管理法》第七十六條規(guī)定:醫(yī)療機(jī)構(gòu)配制的制劑�,應(yīng)當(dāng)是本單位臨床需要而市場(chǎng)上沒有供應(yīng)的品種,并應(yīng)當(dāng)經(jīng)所在地省�、自治區(qū)、直轄市人民政府藥品監(jiān)督管理部門批準(zhǔn)�;但是,法律對(duì)配制中藥制劑另有規(guī)定的除外�。醫(yī)療機(jī)構(gòu)配制的制劑應(yīng)當(dāng)按照規(guī)定進(jìn)行質(zhì)量檢驗(yàn);合格的�,憑醫(yī)師處方在本單位使用。經(jīng)國(guó)務(wù)院藥品監(jiān)督管理部門或者省�、自治區(qū)、直轄市人民政府藥品監(jiān)督管理部門批準(zhǔn)�,醫(yī)療機(jī)構(gòu)配制的制劑可以在指定的醫(yī)療機(jī)構(gòu)之間調(diào)劑使用。醫(yī)療機(jī)構(gòu)配制的制劑不得在市場(chǎng)上銷售�。本文為大家介紹甘肅醫(yī)療機(jī)構(gòu)制劑注冊(cè)流程和要求。
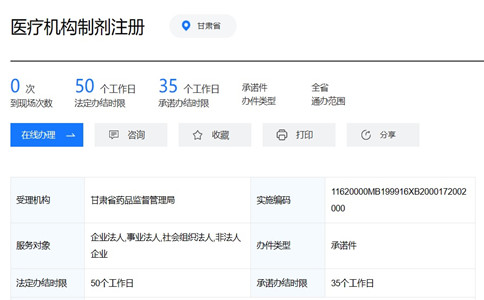
一�、甘肅醫(yī)療機(jī)構(gòu)制劑注冊(cè)受理?xiàng)l件:
1、持有《醫(yī)療機(jī)構(gòu)執(zhí)業(yè)許可證書》并取得具對(duì)應(yīng)配制范圍的《醫(yī)療機(jī)構(gòu)制劑許可證》的醫(yī)療機(jī)構(gòu)�;
2、應(yīng)符合《醫(yī)療機(jī)構(gòu)制劑注冊(cè)管理辦法(試行)》第十四條規(guī)定;
3�、未取得《醫(yī)療機(jī)構(gòu)制劑許可證》或無對(duì)應(yīng)配制范圍的醫(yī)院可以申請(qǐng)中藥制劑注冊(cè),在申請(qǐng)配制時(shí)同時(shí)提出委托配制的申請(qǐng)�。
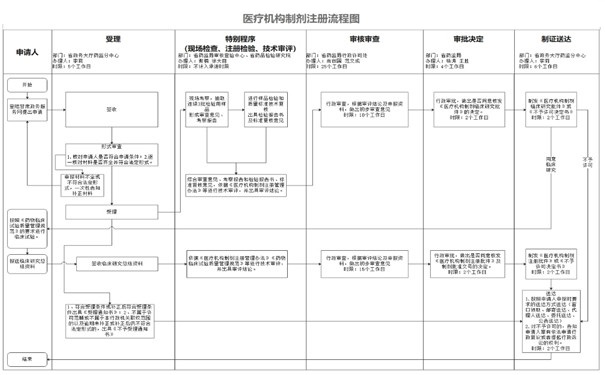
二、甘肅醫(yī)療機(jī)構(gòu)制劑注冊(cè)流程
醫(yī)療機(jī)構(gòu)制劑注冊(cè)流程包括前期準(zhǔn)備�、申請(qǐng)與受理、現(xiàn)場(chǎng)檢查�、注冊(cè)檢驗(yàn)、技術(shù)審評(píng)�、審查、決定�、制證送達(dá)這幾個(gè)主要事項(xiàng),具體詳見下圖:
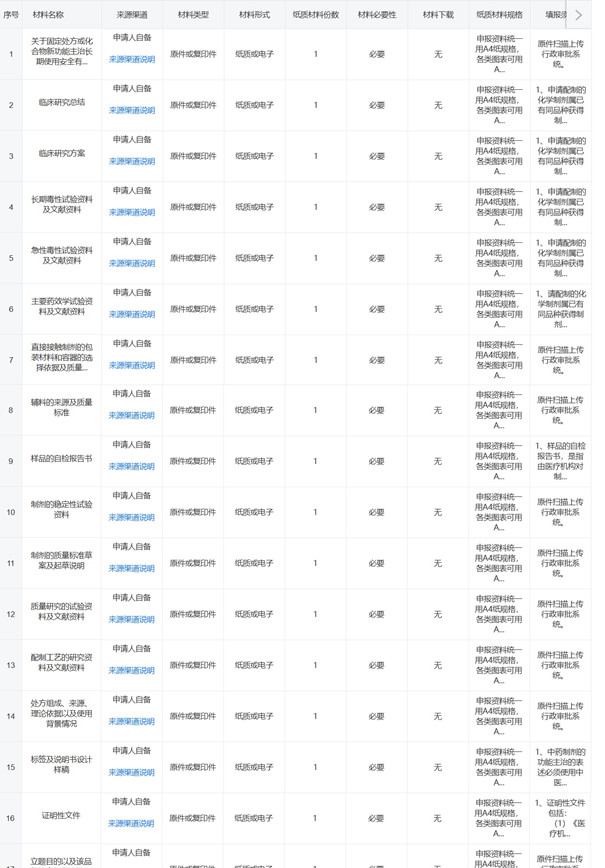
三�、甘肅醫(yī)療機(jī)構(gòu)制劑注冊(cè)要求
甘肅醫(yī)療機(jī)構(gòu)制劑注冊(cè)需要提交包含醫(yī)療機(jī)構(gòu)制劑注冊(cè)申請(qǐng)表、制劑名稱及命名依據(jù)�、主要藥效學(xué)試驗(yàn)資料及文獻(xiàn)資料、毒理學(xué)研究資料�、臨床研究資料等共計(jì)19項(xiàng)資料,醫(yī)療機(jī)構(gòu)制劑注冊(cè)申報(bào)材料清單及相關(guān)要求如下圖所示:
四�、醫(yī)療機(jī)構(gòu)制劑注冊(cè)的法定依據(jù):
《醫(yī)療機(jī)構(gòu)制劑注冊(cè)管理辦法》第二十七條規(guī)定:省級(jí)轄區(qū)內(nèi)申請(qǐng)醫(yī)療機(jī)構(gòu)制劑調(diào)劑使用的�,應(yīng)當(dāng)由使用單位向所在地省、自治區(qū)�、直轄市(食品)藥品監(jiān)督管理部門提出申請(qǐng),說明使用理由�、期限、數(shù)量和范圍,并報(bào)送有關(guān)資料�。省、自治區(qū)�、直轄市之間醫(yī)療機(jī)構(gòu)制劑的調(diào)劑使用以及國(guó)家食品藥品監(jiān)督管理局規(guī)定的特殊制劑的調(diào)劑使用,應(yīng)當(dāng)由取得制劑批準(zhǔn)文號(hào)的醫(yī)療機(jī)構(gòu)向所在地省�、自治區(qū)、直轄市(食品)藥品監(jiān)督管理部門提出申請(qǐng)�,說明使用理由、期限�、數(shù)量和范圍,經(jīng)所在地省�、自治區(qū)、直轄市(食品)藥品監(jiān)督管理部門審查同意后�,由使用單位將審查意見和相關(guān)資料一并報(bào)送使用單位所在地省、自治區(qū)�、直轄市(食品)藥品監(jiān)督管理部門審核同意后,報(bào)國(guó)家食品藥品監(jiān)督管理局審批�。