X射線平板探測(cè)成像設(shè)備注冊(cè)審查指導(dǎo)原則(征求意見稿)旨在指導(dǎo)醫(yī)療器械注冊(cè)申請(qǐng)人規(guī)范X射線平板探測(cè)成像設(shè)備相關(guān)醫(yī)療器械注冊(cè)申報(bào)資料���,同時(shí)也為技術(shù)審評(píng)部門提供參考。本指導(dǎo)原則是對(duì)X射線平板探測(cè)成像設(shè)備的一般要求����,注冊(cè)申請(qǐng)人應(yīng)依據(jù)具體產(chǎn)品的特性對(duì)醫(yī)療器械注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化。注冊(cè)申請(qǐng)人還可依據(jù)具體產(chǎn)品的特性確定其中的具體內(nèi)容是否適用��,若不適用���,需具體闡述其理由及相應(yīng)的科學(xué)依據(jù)���。
X射線平板探測(cè)成像設(shè)備注冊(cè)審查指導(dǎo)原則(征求意見稿)旨在指導(dǎo)醫(yī)療器械注冊(cè)申請(qǐng)人規(guī)范X射線平板探測(cè)成像設(shè)備相關(guān)醫(yī)療器械注冊(cè)申報(bào)資料��,同時(shí)也為技術(shù)審評(píng)部門提供參考��。本指導(dǎo)原則是對(duì)X射線平板探測(cè)成像設(shè)備的一般要求��,注冊(cè)申請(qǐng)人應(yīng)依據(jù)具體產(chǎn)品的特性對(duì)醫(yī)療器械注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化����。注冊(cè)申請(qǐng)人還可依據(jù)具體產(chǎn)品的特性確定其中的具體內(nèi)容是否適用����,若不適用,需具體闡述其理由及相應(yīng)的科學(xué)依據(jù)����。
本指導(dǎo)原則是供注冊(cè)申請(qǐng)人和技術(shù)審評(píng)人員使用的指導(dǎo)性文件,但不包括審評(píng)審批所涉及的行政事項(xiàng)��,亦不作為法規(guī)強(qiáng)制執(zhí)行���,應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則����。如果有能夠滿足相關(guān)法規(guī)要求的其他方法,也可以采用����,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定�����,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善����,以及科學(xué)技術(shù)的不斷發(fā)展�,相關(guān)內(nèi)容也將適時(shí)進(jìn)行調(diào)整。
一�、適用范圍
本指導(dǎo)原則適用于X射線平板探測(cè)成像設(shè)備,產(chǎn)品適用范圍相似的其他醫(yī)療器械��,亦可參考本指導(dǎo)原則�。
申報(bào)產(chǎn)品用于將X射線轉(zhuǎn)換為數(shù)字信號(hào),經(jīng)處理后形成醫(yī)學(xué)圖像����,不包含X射線源裝置�,核心部件一般為平面矩形的固態(tài)傳感器(flat-panel detector, FPD)�����。
關(guān)于本指導(dǎo)原則適用產(chǎn)品的進(jìn)一步說(shuō)明詳見附錄I��。
二����、注冊(cè)審查要點(diǎn)
注冊(cè)申報(bào)資料需要符合國(guó)家藥品監(jiān)督管理局《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》中對(duì)注冊(cè)申報(bào)資料的要求,同時(shí)宜符合以下要求:
(一)監(jiān)管信息
1. 產(chǎn)品名稱
申報(bào)產(chǎn)品宜采用通用名稱�,符合《醫(yī)療器械通用名稱命名規(guī)則》等文件的要求,例如:“X射線平板探測(cè)成像設(shè)備”或“X射線平板探測(cè)器”��。
其中����,“X射線平板探測(cè)成像設(shè)備”的產(chǎn)品組成除了包含探測(cè)器,通常還有圖像工作站軟件��;“X射線平板探測(cè)器”的產(chǎn)品組成中一般不包含圖像工作站軟件�。
申報(bào)產(chǎn)品名稱不建議使用“數(shù)字化X射線成像系統(tǒng)”、“X射線成像系統(tǒng)”等不規(guī)范表述�。
申報(bào)產(chǎn)品不具有X射線發(fā)射源,其核心功能一般僅為接收X射線并輸出醫(yī)學(xué)圖像,必須與其他X射線設(shè)備聯(lián)合使用才能構(gòu)成完整成像系統(tǒng)����,所以申報(bào)產(chǎn)品宜稱作“設(shè)備”或者“裝置”,不建議稱作“系統(tǒng)”�。
2. 分類編碼和管理類別
參考現(xiàn)行有效的《醫(yī)療器械分類目錄》,申報(bào)產(chǎn)品屬于子目錄“06 - 醫(yī)用成像器械”���,一級(jí)產(chǎn)品類別“04 - X射線影像接收處理裝置”��,二級(jí)產(chǎn)品類別“02 - X射線探測(cè)器�、X射線探測(cè)器及其影像系統(tǒng)”�,分類編碼06-04-02。
根據(jù)預(yù)期用途和產(chǎn)品功能��,申報(bào)產(chǎn)品按第二類醫(yī)療器械管理����。產(chǎn)品適用范圍相似的其他醫(yī)療器械�,亦可參考本指導(dǎo)原則。
3. 注冊(cè)單元?jiǎng)澐?/p>
若申報(bào)產(chǎn)品存在多個(gè)型號(hào)規(guī)格或配置���,建議依據(jù)產(chǎn)品適用范圍��、技術(shù)原理�����、結(jié)構(gòu)組成���、性能指標(biāo)等關(guān)鍵要素進(jìn)行注冊(cè)單元?jiǎng)澐帧?/p>
3.1 產(chǎn)品技術(shù)原理存在較大差異的情況���,一般宜劃分為不同的注冊(cè)單元。
例如:
(1)采用間接轉(zhuǎn)換型探測(cè)器的產(chǎn)品����,與采用直接轉(zhuǎn)換型探測(cè)器的產(chǎn)品,宜劃分為不同的注冊(cè)單元��。
(2)采用靜態(tài)探測(cè)器的產(chǎn)品��,與采用動(dòng)態(tài)探測(cè)器的產(chǎn)品��,宜劃分為不同的注冊(cè)單元��。
(3)采用光子計(jì)數(shù)探測(cè)器的產(chǎn)品���,與采用其他常規(guī)探測(cè)器的產(chǎn)品�,宜劃分為不同的注冊(cè)單元。
(4)閃爍體-CMOS-單晶硅探測(cè)器����、閃爍體-TFT-非晶硅探測(cè)器均屬于間接轉(zhuǎn)換方式,考慮到兩者產(chǎn)品結(jié)構(gòu)差異較大��,宜劃分為不同的注冊(cè)單元��。
3.2 產(chǎn)品適用范圍存在較大差異的情況���,一般宜劃分為不同的注冊(cè)單元���。
例如:
(1)使用部位不同。例如:骨科X射線平板探測(cè)設(shè)備��,與乳腺X射線平板探測(cè)設(shè)備����,宜劃分為不同的注冊(cè)單元;
(2)成像模式不同����。例如:僅用于X射線攝影的產(chǎn)品��,與僅用于X射線透視的產(chǎn)品,宜劃分為不同的注冊(cè)單元����。
3.3 其他
若結(jié)構(gòu)設(shè)計(jì)和生產(chǎn)過(guò)程相同、預(yù)期用途相同�、性能指標(biāo)相近、技術(shù)原理基本相同的系列產(chǎn)品及其派生產(chǎn)品���,可以劃為同一注冊(cè)單元��。
例如:
(1)平板探測(cè)器配套使用的圖像處理軟件���,運(yùn)行工作站通用計(jì)算平臺(tái),可以視為獨(dú)立軟件形式的軟件組件�,與平板探測(cè)器納入同一注冊(cè)單元進(jìn)行申報(bào)。若申報(bào)產(chǎn)品包含了符合獨(dú)立軟件定義�、安裝于工作站的圖像處理軟件,相關(guān)軟件一般也可單獨(dú)注冊(cè)申報(bào)����。
若申報(bào)產(chǎn)品包含了已單獨(dú)注冊(cè)上市的圖像處理軟件,需要提供相關(guān)軟件的注冊(cè)資料�����。
(2)若申報(bào)產(chǎn)品的圖像工作站軟件屬于可以選配的部件,并因此形成了兩個(gè)產(chǎn)品配置(配置1:平板探測(cè)器+圖像工作站軟件�����;配置2:僅平板探測(cè)器)���,以上兩個(gè)產(chǎn)品配置可以納入同一注冊(cè)單元進(jìn)行申報(bào)�����。
注冊(cè)單元包含了配置1和2�,或僅包含配置1時(shí)����,申報(bào)產(chǎn)品名稱宜采用“X射線平板探測(cè)成像設(shè)備”。
注冊(cè)單元僅包含配置2時(shí)�,申報(bào)產(chǎn)品名稱宜采用“X射線平板探測(cè)器”。
(二)綜述資料
1. 概述
申請(qǐng)人需要描述產(chǎn)品通用名稱及其確定依據(jù)�、管理類別信息、產(chǎn)品適用范圍���。
若適用����,建議提供申報(bào)產(chǎn)品的背景信息概述�����。
2. 產(chǎn)品描述
2.1 工作原理
申報(bào)產(chǎn)品與兼容的特定醫(yī)用X射線設(shè)備(具有X射線發(fā)生裝置)聯(lián)合使用���,通過(guò)光電轉(zhuǎn)換介質(zhì)將X射線轉(zhuǎn)化為數(shù)字信號(hào)并輸出醫(yī)學(xué)圖像��,用于對(duì)患者進(jìn)行安全��、有效的影像學(xué)檢查�。
建議結(jié)合具體臨床應(yīng)用����,詳細(xì)描述申報(bào)產(chǎn)品工作原理。
2.2 產(chǎn)品類型
2.2.1 成像技術(shù)原理
可以參考注冊(cè)單元?jiǎng)澐衷瓌t以及附錄I進(jìn)行描述�。
提供X射線吸收器件及其所用材料的相關(guān)說(shuō)明,描述基于入射光子能量(keV)或波長(zhǎng)(mm)的X射線探測(cè)性能�,以及可能存在的非線性響應(yīng)特征。
提供X射線能量轉(zhuǎn)換機(jī)制的描述����,并覆蓋全部轉(zhuǎn)換過(guò)程(例如:X射線→可見光→電信號(hào)→圖像)。
若申報(bào)產(chǎn)品支持平板探測(cè)器部分區(qū)域成像(例如:僅掃描部分像素矩陣)���,需要提供探測(cè)器矩陣局部曝光和數(shù)據(jù)讀出方法的詳細(xì)說(shuō)明��。
提供X射線束與申報(bào)產(chǎn)品有效接收區(qū)域進(jìn)行對(duì)準(zhǔn)的操作說(shuō)明�,包括描述用于指示有效接收區(qū)域的產(chǎn)品標(biāo)記等。
說(shuō)明申報(bào)產(chǎn)品允許的像素缺陷類型和數(shù)量��,以及用于補(bǔ)償或消除像素缺陷所用的技術(shù)和方法�。
提供產(chǎn)品成像恢復(fù)時(shí)間的必要描述,說(shuō)明像素矩陣讀出結(jié)束后至可以接受下次曝光的時(shí)間間隔�。
2.2.2 預(yù)期用途
(1)預(yù)期與其他器械聯(lián)合使用。例如:便攜式平板探測(cè)器��,具有完整的外殼和接口�。
(2)作為醫(yī)用X射線設(shè)備的部件并用于整機(jī)生產(chǎn)。
(3)影像檢查模式�。例如:攝影、透視等��。若適用�����,提供幀率等動(dòng)態(tài)成像性能的必要說(shuō)明�,包括單位時(shí)間可產(chǎn)生的最大圖像數(shù)量。
(4)使用部位���。例如:骨科�、乳腺等。
2.2.3 射線能量轉(zhuǎn)換方式��。例如:直接轉(zhuǎn)換和間接轉(zhuǎn)換���。
2.2.4 閃爍體類型。例如:硫氧化釓(gadolinium oxysulfide, GOS)����、碘化銫(cesium iodide, CsI)。
2.2.5 曝光觸發(fā)方式
(1)自動(dòng)曝光檢測(cè)模式(automatic exposure detection�����, AED)
X射線曝光后�����,申報(bào)產(chǎn)品自動(dòng)探測(cè)曝光事件并觸發(fā)信號(hào)采集��,其成像過(guò)程無(wú)需與X射線發(fā)生裝置之間建立同步信號(hào)的交互路徑�。申報(bào)產(chǎn)品與X射線發(fā)生裝置構(gòu)成的完整成像系統(tǒng)的連接示例見圖1。
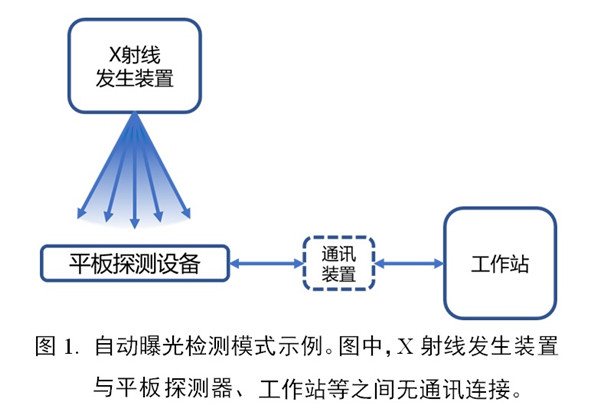
(2)外部同步信號(hào)觸發(fā)模式
申報(bào)產(chǎn)品和X射線發(fā)生裝置之間具有同步信號(hào)連接纜線�����。X射線發(fā)生裝置在曝光時(shí),發(fā)送同步信號(hào)至申報(bào)產(chǎn)品的特定接口�,啟動(dòng)平板探測(cè)器圖像信號(hào)采集流程。
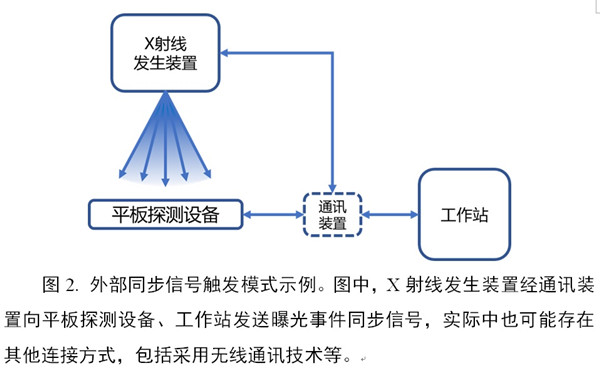
(3)手動(dòng)觸發(fā)模式
申報(bào)產(chǎn)品和X射線發(fā)生裝置之間無(wú)同步信號(hào)�。例如:X射線曝光和平板探測(cè)器的圖像采集工作均由用戶手動(dòng)觸發(fā)。
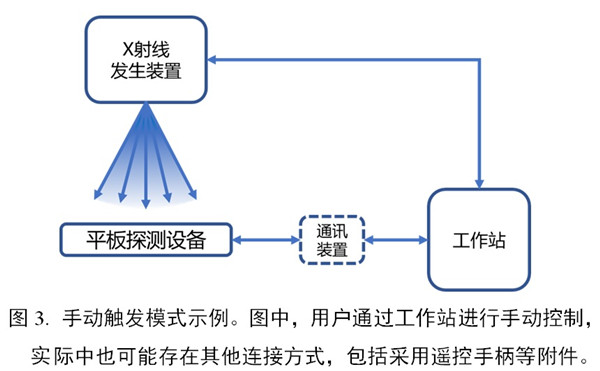
2.1.1 通信模式
申報(bào)產(chǎn)品一般需要與醫(yī)學(xué)影像設(shè)備主機(jī)����、圖像工作站等進(jìn)行通信,傳輸曝光控制信號(hào)���、圖像數(shù)據(jù)等�。產(chǎn)品通信模式一般分為有線和無(wú)線兩類����,需要說(shuō)明相關(guān)電纜接口、通信頻率和帶寬等具體信息���。
2.2 產(chǎn)品結(jié)構(gòu)和組成
申報(bào)產(chǎn)品一般由平板探測(cè)器���、供電和通信裝置、圖像處理軟件、附件和選配件等組成�,需要描述其與醫(yī)用X射線整機(jī)設(shè)備的機(jī)械、電氣連接關(guān)系�,提供臨床標(biāo)準(zhǔn)操作流程的簡(jiǎn)要說(shuō)明。
2.2.1 平板探測(cè)器
平板探測(cè)器屬于申報(bào)產(chǎn)品的核心部件����,一般包括光電轉(zhuǎn)換介質(zhì)、數(shù)模轉(zhuǎn)化電路��、通信模塊等���。
申請(qǐng)人需要提供平板探測(cè)器的真實(shí)照片和工程圖示(包含內(nèi)部結(jié)構(gòu)),標(biāo)注尺寸信息��,宜結(jié)合圖示說(shuō)明平板探測(cè)器內(nèi)部結(jié)構(gòu)組成(晶體材料��、電路布局等)�。例如:提供平板探測(cè)器的橫截面圖示,通過(guò)縱向展示器械元件布局(光電轉(zhuǎn)換路徑)�,逐步說(shuō)明X射線轉(zhuǎn)換和信號(hào)生成的方法和過(guò)程;提供信號(hào)存儲(chǔ)的原理示意圖���,描述信號(hào)讀出機(jī)制�。
若申報(bào)產(chǎn)品包含多個(gè)探測(cè)器型號(hào),需要詳細(xì)說(shuō)明各個(gè)型號(hào)之間的差異�。
2.2.2 供電和通信裝置
一般具有通信和供電功能,用于傳輸圖像數(shù)據(jù)和控制指令���。建議提供申報(bào)產(chǎn)品與X射線發(fā)生裝置所構(gòu)成的完整成像系統(tǒng)的整體連接框圖�,說(shuō)明產(chǎn)品主要部件��、附件和選配件的電氣連接關(guān)系�。
申請(qǐng)人需要詳述產(chǎn)品接口信息,包括類型�、功能、傳輸數(shù)據(jù)內(nèi)容等����。若采用無(wú)線通信技術(shù),建議提供無(wú)線電核準(zhǔn)證書����,說(shuō)明無(wú)線通信參數(shù)(例如:功率、頻率等)����,描述通過(guò)無(wú)線技術(shù)所實(shí)現(xiàn)的產(chǎn)品功能。
2.2.3 軟件組件
一般包括嵌入式軟件(例如:實(shí)現(xiàn)采集控制功能)和圖像工作站軟件(例如:實(shí)現(xiàn)圖像接收���、處理和存儲(chǔ)等功能)���。
2.2.4 附件和選配件
參考產(chǎn)品整體配置圖��,提供附件和選配件的必要描述�,說(shuō)明主要部件��、附件和選配件的連接關(guān)系�����。
2.3 產(chǎn)品技術(shù)特征
提供產(chǎn)品成像功能�、圖像處理功能的詳細(xì)描述�����,識(shí)別產(chǎn)品關(guān)鍵技術(shù)特征����。
表1. 產(chǎn)品技術(shù)特征示例
序號(hào) | 技術(shù)特征 | 說(shuō)明 |
1 | 自動(dòng)曝光檢測(cè) | X射線曝光自動(dòng)觸發(fā)的數(shù)據(jù)采集 |
2 | 采集技術(shù) | 靜態(tài)成像、動(dòng)態(tài)成像����、光子計(jì)數(shù)等 |
3 | 低劑量設(shè)計(jì) | 適用于兒童成像 |
3. 型號(hào)規(guī)
格申請(qǐng)人需要明確申報(bào)產(chǎn)品的型號(hào)規(guī)格,提供產(chǎn)品配置表(附錄II)。若申報(bào)產(chǎn)品包含多種型號(hào)規(guī)格���,需要說(shuō)明各型號(hào)規(guī)格之間的產(chǎn)品配置差異���。
4. 參考的同類產(chǎn)品或前代產(chǎn)品的情況
列表比較說(shuō)明申報(bào)產(chǎn)品與同類產(chǎn)品或前代產(chǎn)品的差異,對(duì)比內(nèi)容需要包括產(chǎn)品的工作原理��、結(jié)構(gòu)組成�、制造材料、性能指標(biāo)�、適用范圍、臨床功能和產(chǎn)品技術(shù)特征等方面����,并重點(diǎn)描述申報(bào)產(chǎn)品的新技術(shù)、新特征和新功能�����。
5. 適用范圍和禁忌證
5.1 適用范圍或預(yù)期用途
5.1.1 預(yù)期作為部件用于醫(yī)用X射線設(shè)備整機(jī)生產(chǎn)
申報(bào)產(chǎn)品若預(yù)期作為部件��,供醫(yī)療器械整機(jī)制造商生產(chǎn)X射線設(shè)備使用���,其注冊(cè)證載明的適用范圍的示例如下:
該產(chǎn)品作為部件提供給醫(yī)療器械整機(jī)制造商����,配套特定醫(yī)用X射線設(shè)備,用于X射線攝影成像�����。
5.1.2 預(yù)期與特定醫(yī)用X射線設(shè)備聯(lián)合使用
若申報(bào)產(chǎn)品預(yù)期與特定醫(yī)用X射線設(shè)備聯(lián)合使用實(shí)現(xiàn)預(yù)期用途����,需要在產(chǎn)品技術(shù)要求中明確聯(lián)合使用器械的具體要求(例如:在產(chǎn)品技術(shù)要求的小節(jié)1中載明特定醫(yī)用X射線設(shè)備的種類、名稱���、型號(hào)規(guī)格等信息)��。
針對(duì)申報(bào)產(chǎn)品宣稱可以聯(lián)合使用的全部型號(hào)規(guī)格的醫(yī)用X射線設(shè)備��,申請(qǐng)人需要提供充分的產(chǎn)品兼容性評(píng)價(jià)資料,充分論證兩者聯(lián)合使用的安全性和有效性���,具體要求詳見附錄V��。
醫(yī)療器械注冊(cè)證載明的適用范圍的示例如下:
該產(chǎn)品與特定醫(yī)用X射線設(shè)備聯(lián)合使用�,用于X射線攝影���、透視成像����。
5.1 預(yù)期使用環(huán)境
(1)使用地點(diǎn),例如:院內(nèi)����、院外(車載環(huán)境)等。
(2)使用環(huán)境���,例如:溫度�����、濕度��、大氣壓等���。
5.2 兒童使用
若申報(bào)產(chǎn)品適用于兒童成像檢查,需要提供兒童使用情況的說(shuō)明��。例如:兒童成像一般需要考慮采用低劑量方式��,建議詳細(xì)說(shuō)明推薦的低劑量成像協(xié)議��,提供相應(yīng)的研究資料。
2. 其他需說(shuō)明的內(nèi)容
申報(bào)產(chǎn)品需要提供預(yù)期聯(lián)合使用的醫(yī)療器械信息���,詳細(xì)描述產(chǎn)品接口設(shè)計(jì)�����,以及兩者之間的連接關(guān)系�,包括機(jī)械和電氣連接���、數(shù)據(jù)交換���、信號(hào)控制等。
(一)非臨床資料
1. 產(chǎn)品風(fēng)險(xiǎn)管理資料
申報(bào)產(chǎn)品需要提供與醫(yī)用X射線設(shè)備聯(lián)合使用的風(fēng)險(xiǎn)管理資料����,詳細(xì)說(shuō)明風(fēng)險(xiǎn)分析、風(fēng)險(xiǎn)評(píng)價(jià)��、風(fēng)險(xiǎn)控制����、剩余風(fēng)險(xiǎn)可接受性����、風(fēng)險(xiǎn)綜合評(píng)價(jià)等重要內(nèi)容���。
申請(qǐng)人宜提供采取風(fēng)險(xiǎn)控制措施前后的風(fēng)險(xiǎn)矩陣對(duì)比表。風(fēng)險(xiǎn)分析需要符合GB/T 42062《醫(yī)療器械 風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》的要求���。下表結(jié)合申報(bào)產(chǎn)品特征��,簡(jiǎn)要列舉了建議重點(diǎn)關(guān)注的主要風(fēng)險(xiǎn)��。
1. 醫(yī)療器械安全和性能基本原則清單
申請(qǐng)人需要提供《醫(yī)療器械安全和性能基本原則清單》�,說(shuō)明申報(bào)產(chǎn)品為符合適用的各項(xiàng)要求所采用的方法�����,以及證明其符合性的文件�。對(duì)于不適用的各項(xiàng)要求,申請(qǐng)人需要詳細(xì)說(shuō)明理由��。
2. 產(chǎn)品性能研究
2.1 申報(bào)產(chǎn)品適用標(biāo)準(zhǔn)情況
列表說(shuō)明申報(bào)產(chǎn)品需要符合的國(guó)家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)���,可以參考附錄III示例��。對(duì)于強(qiáng)制性行業(yè)標(biāo)準(zhǔn)���,若申報(bào)產(chǎn)品結(jié)構(gòu)特征�����、預(yù)期用途���、使用方式等與強(qiáng)制性標(biāo)準(zhǔn)的適用范圍不一致,需要提供不適用強(qiáng)制性標(biāo)準(zhǔn)的說(shuō)明�,以及經(jīng)驗(yàn)證的證明性資料。
2.2 產(chǎn)品技術(shù)要求
申請(qǐng)人編制產(chǎn)品技術(shù)要求時(shí)��,需要符合《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》等文件規(guī)定����,可以參考本指導(dǎo)原則附錄IV的模板示例。
2.2.1 產(chǎn)品型號(hào)/規(guī)格及其劃分說(shuō)明
描述產(chǎn)品型號(hào)/規(guī)格���,提供產(chǎn)品配置表����。
描述軟件組件名稱��、軟件發(fā)布版本、軟件版本命名規(guī)則�����,明確軟件版本的全部字段�,逐項(xiàng)說(shuō)明每字段含義并提供相應(yīng)軟件更新的典型示例����。
2.2.2 性能指標(biāo)
產(chǎn)品性能指標(biāo)條款可以參照適用的國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)等文件要求��,結(jié)合產(chǎn)品技術(shù)特征進(jìn)行制定���。申請(qǐng)人需要依據(jù)產(chǎn)品實(shí)際應(yīng)用情況����,在性能指標(biāo)條款中列明驗(yàn)收閾值等重要參數(shù)的具體數(shù)值(例如:范圍���、誤差等)�。
此外��,產(chǎn)品性能指標(biāo)需要考慮以下內(nèi)容:
(1)若適用��,需要考慮符合YY/T 0933、YY/T 0934���、YY/T 1307-2023等標(biāo)準(zhǔn)要求�。
(2)產(chǎn)品工作模式
? 同步觸發(fā)和手動(dòng)觸發(fā)模式
宜明確產(chǎn)品接口等方面的要求�����,例如:適配機(jī)型��、接口類型���、響應(yīng)時(shí)間�����、曝光劑量等����。
? 自動(dòng)曝光檢測(cè)模式
宜規(guī)定最小曝光觸發(fā)劑量�����,以及推薦的最小曝光觸發(fā)劑量率(μGy/s)�。
? 通信模式
采用有線或無(wú)線通信技術(shù)的產(chǎn)品����,特別是無(wú)線平板探測(cè)器或具有無(wú)線通信功能的產(chǎn)品附件(曝光手閘���、遙控器等),宜明確通信技術(shù)相關(guān)的產(chǎn)品功能����、接口及網(wǎng)絡(luò)安全的相關(guān)要求,在產(chǎn)品配置表中備注接口類型��、通信頻率����、帶寬、無(wú)線功率��、通信協(xié)議等信息�。
表1. 產(chǎn)品典型工作模式的示例
| 工作模式 | 描述 |
1. | 外接電源供電, 無(wú)線傳輸 | 產(chǎn)品工作時(shí)由外接電源供電��,同時(shí)可對(duì)內(nèi)部電源充電��,采用無(wú)線方式與工作站等進(jìn)行通信�,完成圖像采集����、數(shù)據(jù)傳輸?shù)热蝿?wù)�����。 |
2. | 內(nèi)部電源供電����, 無(wú)線傳輸 | 產(chǎn)品工作時(shí)由內(nèi)部電源供電,采用無(wú)線方式進(jìn)行通信��。 |
3. | 外接電源供電����, 有線傳輸 | 產(chǎn)品工作時(shí)由外接電源供電,同時(shí)對(duì)內(nèi)部電源充電��,采用有線方式經(jīng)過(guò)專用線纜進(jìn)行通信����。 |
4. | 內(nèi)部電源供電, 有線傳輸 | 產(chǎn)品工作時(shí)由內(nèi)部電源供電����,采用有線方式經(jīng)過(guò)專用線纜進(jìn)行通信����。 |
(3)成像時(shí)間:若適用��,建議規(guī)定典型或標(biāo)稱的成像時(shí)間����,可參考YY/T 0741中“成像時(shí)間”的要求以及測(cè)試方法。(4)軟件組件:若適用����,建議依據(jù)產(chǎn)品說(shuō)明書內(nèi)容����,制定軟件功能相關(guān)要求,包括圖像處理和分析等����。
(5)網(wǎng)絡(luò)安全:需要明確數(shù)據(jù)接口、用戶訪問(wèn)控制要求����。對(duì)于特殊或?qū)S玫臒o(wú)線通信裝置,建議提交符合無(wú)線電管理規(guī)定的證明材料�����。
2.2.3 檢驗(yàn)方法
建議注明引用標(biāo)準(zhǔn)的編號(hào)、年代號(hào)及條款號(hào)�。
2.2.4 附錄
建議列明產(chǎn)品安全特征,提供絕緣圖�、絕緣路徑表。
2.3 產(chǎn)品檢驗(yàn)報(bào)告
檢驗(yàn)報(bào)告需要注明產(chǎn)品型號(hào)規(guī)格或配置�����,樣品描述需要與產(chǎn)品技術(shù)要求的部件名稱和型號(hào)等信息保持一致�。
檢驗(yàn)報(bào)告需要提供軟件版本界面的真實(shí)照片或列明軟件版本信息。具有用戶界面的軟件需要體現(xiàn)軟件發(fā)布版本和軟件完整版本����,無(wú)用戶界面的軟件需要體現(xiàn)軟件完整版本。
2.3.1 同一注冊(cè)單元的典型檢驗(yàn)產(chǎn)品
申請(qǐng)人需要按照注冊(cè)單元進(jìn)行產(chǎn)品檢驗(yàn)��,檢驗(yàn)結(jié)果需要覆蓋注冊(cè)單元內(nèi)所有產(chǎn)品型號(hào)規(guī)格或配置�。典型檢驗(yàn)產(chǎn)品需要考慮結(jié)構(gòu)組成、性能指標(biāo)��、預(yù)期用途等��,一般選取功能最齊全��、結(jié)構(gòu)最復(fù)雜、風(fēng)險(xiǎn)最高的產(chǎn)品型號(hào)規(guī)格或配置���,并提供檢驗(yàn)典型性說(shuō)明�。
對(duì)于現(xiàn)有檢驗(yàn)結(jié)果未能覆蓋的產(chǎn)品型號(hào)規(guī)格或配置��,除了進(jìn)一步增加檢驗(yàn)典型產(chǎn)品型號(hào)之外���,至少需要考慮進(jìn)行差異檢驗(yàn)���。例如:配置1和配置2的閃爍體材料不同,其他組件�、材料等相同(包括圖像工作站軟件)��,導(dǎo)致配置之間的部分性能指標(biāo)存在差異�,以及涉及成像性能、圖像質(zhì)量的檢驗(yàn)結(jié)果無(wú)法互相覆蓋��,可以考慮開展差異檢驗(yàn)���。
2.3.2 產(chǎn)品性能和安規(guī)檢驗(yàn)
(1)應(yīng)用模式
若申報(bào)產(chǎn)品具有多種應(yīng)用模式(或工作模式)���,建議合理選取典型應(yīng)用模式并逐項(xiàng)進(jìn)行檢驗(yàn)��,提供選取理由和依據(jù)��。
例如:典型模式是否選取了自動(dòng)曝光����、同步觸發(fā)��、手動(dòng)觸發(fā)等主要模式�;是否所有典型模式均進(jìn)行了檢驗(yàn);是否不同典型模式之間具有一定的檢驗(yàn)覆蓋性���,并選取差異項(xiàng)目進(jìn)行了檢驗(yàn)���。
(2)配套檢驗(yàn)的其他醫(yī)療器械
申請(qǐng)人需要說(shuō)明檢驗(yàn)用X射線發(fā)生裝置的選取理由,例如:是否具有典型性��。
2.3.3 產(chǎn)品電磁兼容檢驗(yàn)
申請(qǐng)人需要提供EMC檢驗(yàn)中產(chǎn)品運(yùn)行模式的選取依據(jù)�����??箶_度試驗(yàn)中,產(chǎn)品基本性能相關(guān)的功能均應(yīng)考慮對(duì)患者產(chǎn)生最不利影響的試驗(yàn)方式。輻射發(fā)射試驗(yàn)中���,產(chǎn)品宜在最大騷擾狀態(tài)下運(yùn)行�。
2.3.4 關(guān)于檢驗(yàn)情況的說(shuō)明
申請(qǐng)人宜提供檢驗(yàn)情況說(shuō)明和檢驗(yàn)報(bào)告清單�����,簡(jiǎn)要描述檢驗(yàn)報(bào)告對(duì)應(yīng)的產(chǎn)品型號(hào)規(guī)格�����、產(chǎn)品配置和檢驗(yàn)內(nèi)容(性能和安規(guī)檢驗(yàn)��、EMC檢驗(yàn)等)��。
3. 研究資料
4.1 化學(xué)和物理性能研究���、電氣系統(tǒng)安全性研究
申請(qǐng)人需要提供產(chǎn)品性能研究資料�����,以及產(chǎn)品技術(shù)要求的編制說(shuō)明,列表說(shuō)明產(chǎn)品性能指標(biāo)條款��,逐項(xiàng)解釋條款來(lái)源和制定依據(jù)����。
申請(qǐng)人需要說(shuō)明適用的標(biāo)準(zhǔn)或方法���,解釋引用或采用的理由。關(guān)于適用標(biāo)準(zhǔn)中的不適用條款���,需要提供必要的說(shuō)明�。
4.1.1 產(chǎn)品工作模式和圖像質(zhì)量研究
申請(qǐng)人可以結(jié)合綜述資料中描述的產(chǎn)品應(yīng)用模式��、工作模式或運(yùn)行模式���,提供內(nèi)部自行開展的測(cè)試驗(yàn)證資料���。例如:
(1)X射線曝光觸發(fā)方式的時(shí)序圖,描述從產(chǎn)品啟動(dòng)至輸出圖像給用戶的典型曝光順序(觸發(fā)���、準(zhǔn)備����、曝光��、數(shù)據(jù)讀取等),并驗(yàn)證工作狀態(tài)指示��、圖像質(zhì)量等項(xiàng)目��。
(2)量子探測(cè)效率(DQE)的研究資料:若適用�����,說(shuō)明采用的統(tǒng)計(jì)學(xué)估計(jì)方法以及估計(jì)結(jié)果���,提供誤差擴(kuò)散等導(dǎo)致的不確定度的分析���。
(3)調(diào)制傳遞函數(shù)(MTF)的研究資料:提供調(diào)制傳遞函數(shù)曲線,說(shuō)明測(cè)試用的產(chǎn)品設(shè)置和輸入劑量水平�����,以及在典型臨床曝光條件下����,申報(bào)產(chǎn)品可以提供的最大和最小傳遞函數(shù)。
(4)對(duì)于規(guī)定的X射線光譜范圍(例如:kVp和濾過(guò))���,提供輸入劑量與輸出信號(hào)的關(guān)系曲線圖,并結(jié)合圖示描述兩者可能存在的非線性關(guān)系。申請(qǐng)人也可以使用其他方法對(duì)產(chǎn)品動(dòng)態(tài)范圍能力進(jìn)行表征和評(píng)價(jià)��,并提供相應(yīng)的研究資料����。
(5)考慮短期和長(zhǎng)期接觸曝光,產(chǎn)品出現(xiàn)的延遲或殘余信號(hào)水平����,分析輸出圖像中包含前次的一個(gè)或多個(gè)曝光產(chǎn)生的信號(hào)分量的效應(yīng),說(shuō)明此類信號(hào)的相對(duì)幅度和衰減特征����。
(6)圖像均勻性的研究資料:建議分別考慮最小/最大視野、部分/全部探測(cè)矩陣等不同因素影響�����,分析說(shuō)明圖像不均勻性的最惡劣情況��,及其可接受性��。
4.1.2 患者成像劑量研究
劑量要求和相互作用變化:提供為產(chǎn)生與對(duì)比器械等同的靜態(tài)或動(dòng)態(tài)圖像所需要的輸入劑量����。申請(qǐng)人宜說(shuō)明可能的最小����、最大成像劑量(例如:采用申報(bào)產(chǎn)品與采用傳統(tǒng)膠片進(jìn)行X射線攝影成像����,兩者典型患者照射劑量的差異分析說(shuō)明),驗(yàn)證不同劑量條件下的產(chǎn)品功能及圖像質(zhì)量���,提供研究方案和研究報(bào)告�。此外�,動(dòng)態(tài)平板探測(cè)器預(yù)期用于長(zhǎng)時(shí)間連續(xù)成像,建議同時(shí)提供產(chǎn)品散熱性能的評(píng)價(jià)研究資料�����。
4.1.3 聯(lián)合使用研究
申請(qǐng)人可以參考附錄V�,提供申報(bào)產(chǎn)品與特定醫(yī)用X射線設(shè)備的兼容性研究報(bào)告,形成可以聯(lián)合使用的產(chǎn)品清單����,并在產(chǎn)品技術(shù)要求的附錄中進(jìn)行說(shuō)明。
若適用���,申請(qǐng)人宜選取典型成像協(xié)議進(jìn)行驗(yàn)證����,并說(shuō)明測(cè)試體模��、試驗(yàn)方法和驗(yàn)證標(biāo)準(zhǔn)����。
4.1.4 電池性能和安全評(píng)價(jià)
申報(bào)產(chǎn)品一般具有內(nèi)部電源及其充電裝置,通常支持多路供電方式���,建議提供電池安全研究資料�����。除符合GB9706.1-2020中7.3.3��、15.4.3的要求外����,對(duì)于使用鋰離子電池及電池組的產(chǎn)品�,亦需要考慮符合GB31241-2014《便攜式電子產(chǎn)品用鋰離子電池及電池組安全要求》。關(guān)于電池持續(xù)工作時(shí)間�,一般需要考慮的主要影響因素包括:曝光次數(shù)、電池壽命和充電狀態(tài)等�。若適用��,宜說(shuō)明特定條件下電池預(yù)計(jì)剩余工作時(shí)間的估算方法��。
4.2 軟件研究
申請(qǐng)人可以依據(jù)《醫(yī)療器械軟件注冊(cè)審查指導(dǎo)原則》���,提供軟件研究資料。軟件研究報(bào)告需要覆蓋全部軟件組件�,并建議關(guān)聯(lián)綜述資料、產(chǎn)品說(shuō)明書描述的產(chǎn)品功能���。
申報(bào)產(chǎn)品的軟件組件一般包含嵌入式軟件和圖像處理軟件等����,其軟件安全性級(jí)別建議為中等(B)級(jí)����。
申請(qǐng)人宜依據(jù)產(chǎn)品說(shuō)明書,列明軟件核心功能的相關(guān)信息��,所用核心算法可以參考下表示例��。必要時(shí)�,可以提供專題研究資料,針對(duì)某個(gè)核心算法進(jìn)行詳述��。
表2. 核心功能和核心算法示例
核心功能 | 核心算法 | 預(yù)期用途 |
圖像處理 (成熟) | 圖像降噪 (成熟) | 通過(guò)噪聲估計(jì)和最優(yōu)化方法減小圖像噪聲 |
圖像處理 (成熟) | 金屬偽影消除 (成熟) | 去除金屬造成的圖像偽影 |
… | … | … |
申請(qǐng)人需要描述軟件完整版本的全部字段和字段含義,逐項(xiàng)針對(duì)字段進(jìn)行舉例說(shuō)明�,并確定軟件完整版本和發(fā)布版本。申請(qǐng)人可以參照《醫(yī)療器械網(wǎng)絡(luò)安全注冊(cè)審查指導(dǎo)原則》提供網(wǎng)絡(luò)安全研究資料���。
若申報(bào)產(chǎn)品各部件/組件之間采用了無(wú)線通信技術(shù)��,建議說(shuō)明:保證無(wú)線通信質(zhì)量的措施,以確保整個(gè)系統(tǒng)的安全性和有效性���;必要的無(wú)線通信安全措施���;與其他無(wú)線通信設(shè)備的共存問(wèn)題,以及相關(guān)風(fēng)險(xiǎn)緩解措施�。
4.3 生物學(xué)特性研究
若申報(bào)產(chǎn)品外表面預(yù)期與患者接觸,需要說(shuō)明與人體接觸的部件����、材料、接觸方式����、接觸部位和接觸時(shí)間等必要信息。申請(qǐng)人可以依據(jù)GB16886.1《醫(yī)療器械生物學(xué)評(píng)價(jià)第1部分:風(fēng)險(xiǎn)管理過(guò)程中的評(píng)價(jià)與試驗(yàn)》的方法�����,開展生物學(xué)評(píng)價(jià)研究。
若申報(bào)產(chǎn)品僅作為部件提供給醫(yī)療器械整機(jī)制造企業(yè)����,預(yù)期與患者無(wú)直接或間接接觸,可以提供生物相容性評(píng)價(jià)的不適用聲明���。
4.4 清潔和消毒研究
4.4.1 使用者清潔和消毒
申請(qǐng)人可以依據(jù)綜述資料�、產(chǎn)品說(shuō)明書相關(guān)內(nèi)容���,說(shuō)明推薦的消毒周期�����、消毒方式�����、消毒劑的型號(hào)和供應(yīng)商等����。若適用,建議說(shuō)明不同的消毒劑的消毒效果�,提供相關(guān)研究資料。
4.4.2 殘留毒性
若清潔���、消毒方法可能出現(xiàn)殘留����,申請(qǐng)人需要提供殘留物毒性的相關(guān)研究資料��。
4. 穩(wěn)定性研究
5.1 使用穩(wěn)定性
申請(qǐng)人可以依據(jù)《有源醫(yī)療器械使用期限注冊(cè)技術(shù)審查指導(dǎo)原則》����,提供產(chǎn)品使用期限的研究資料����。
(1)分別考慮在正常條件和不利條件下對(duì)產(chǎn)品開展評(píng)價(jià)研究。
(2)提供產(chǎn)品主要部件列表�,逐項(xiàng)說(shuō)明部件使用期限,例如:平板探測(cè)器���、閃爍體����、電池、通信裝置等�����。
(3)說(shuō)明產(chǎn)品有效期內(nèi)X射線累積輻射總劑量���,以及每日預(yù)期劑量��,證明預(yù)期壽命的合理性�。
(4)提供輻射損傷的驗(yàn)證資料�,包括調(diào)制傳遞函數(shù)、量子探測(cè)效率等關(guān)鍵指標(biāo)與X射線累積劑量(拍攝次數(shù))的關(guān)系曲線����,以及疲勞測(cè)試后的可接受準(zhǔn)則,并說(shuō)明相關(guān)驗(yàn)收參數(shù)的選取依據(jù)���。
(5)說(shuō)明測(cè)試用X射線發(fā)生裝置及測(cè)試參數(shù)的選取依據(jù)�。
(6)提供電池壽命的評(píng)價(jià)研究資料���。
5.2 運(yùn)輸穩(wěn)定性
申請(qǐng)人需要提供運(yùn)輸穩(wěn)定性和包裝研究資料����,證明在規(guī)定的運(yùn)輸條件下,運(yùn)輸過(guò)程中的環(huán)境條件不會(huì)對(duì)醫(yī)療器械造成不利影響��。
環(huán)境試驗(yàn)研究可以依據(jù)產(chǎn)品預(yù)期用途����,參考GB/T 14710、YY/T 0291等相關(guān)標(biāo)準(zhǔn)進(jìn)行研究����。環(huán)境試驗(yàn)的中間或最后檢測(cè)項(xiàng)目,可參考YY/T 0933����、YY/T 0934、YY/T 1307等標(biāo)準(zhǔn)條款規(guī)定��,至少包括“工作狀態(tài)指示”���、“空間分辨率”等項(xiàng)目。
關(guān)于含有內(nèi)部電池的產(chǎn)品��,建議說(shuō)明運(yùn)輸安全的考慮����,并提供相應(yīng)評(píng)價(jià)資料。
5. 其他研究資料
申請(qǐng)人可以依據(jù)產(chǎn)品特征,進(jìn)一步提供其他專題研究資料����。
6.1 新技術(shù)、新特征�、新功能的研究資料。若適用�����,申請(qǐng)人宜詳述工作原理�、實(shí)現(xiàn)方式、臨床應(yīng)用場(chǎng)景����、預(yù)期用途、標(biāo)準(zhǔn)操作流程等內(nèi)容�,并說(shuō)明驗(yàn)證標(biāo)準(zhǔn)、測(cè)試規(guī)范��、測(cè)試體模和測(cè)試裝置等信息����,提供研究方案和研究報(bào)告。
6.2 兒童應(yīng)用的研究資料��。若適用,建議參考兒童X射線產(chǎn)品的相關(guān)指導(dǎo)原則����,提供適用兒童的年齡范圍、體型�、部位等信息。申請(qǐng)人宜說(shuō)明與兒童檢查相關(guān)的產(chǎn)品設(shè)計(jì)或功能���,以及風(fēng)險(xiǎn)評(píng)估過(guò)程����,分析兒童應(yīng)用可能出現(xiàn)的危險(xiǎn)并提供相應(yīng)的緩解措施��。申請(qǐng)人宜說(shuō)明兒童成像檢查的注意事項(xiàng)��,提供圖像質(zhì)量和成像劑量的評(píng)價(jià)研究資料��,包括測(cè)試用模體�、典型成像協(xié)議和掃描參數(shù)(例如:管電壓、管電流�、是否使用劑量調(diào)制功能等)���。
(一)臨床評(píng)價(jià)資料
申報(bào)產(chǎn)品已列入《免于臨床評(píng)價(jià)醫(yī)療器械目錄(2023年)》(序號(hào)271)���,可以按照《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》���、《列入免于臨床評(píng)價(jià)醫(yī)療器械目錄產(chǎn)品對(duì)比說(shuō)明技術(shù)指導(dǎo)原則》的要求提交對(duì)比說(shuō)明資料,宜重點(diǎn)關(guān)注申報(bào)產(chǎn)品的新技術(shù)����、新特征、新功能�����,相關(guān)性能指標(biāo)可以參考YY/T 0933����、YY/T 0934、YY/T 1307-2023等標(biāo)準(zhǔn)要求�。
若申報(bào)產(chǎn)品與對(duì)比產(chǎn)品存在差異,需要詳述相關(guān)差異的具體情況���,提供研究資料證明上述差異對(duì)申報(bào)產(chǎn)品的安全性和有效性未造成不利影響��。
若無(wú)法證明申報(bào)產(chǎn)品與《目錄》所述的產(chǎn)品具有基本等同性�,則應(yīng)開展臨床評(píng)價(jià)��,例如:
(1)采用全新的工作原理和結(jié)構(gòu)設(shè)計(jì),屬于同品種首個(gè)產(chǎn)品的情況�����。
(2)適用范圍新增了能譜成像等產(chǎn)品用途����,相關(guān)內(nèi)容超出了《目錄》范圍。
(3)采用未經(jīng)充分臨床驗(yàn)證的新器件或新技術(shù)��,可能對(duì)圖像質(zhì)量產(chǎn)生較大影響��。
(二)產(chǎn)品說(shuō)明書和標(biāo)簽
產(chǎn)品說(shuō)明書需要覆蓋申報(bào)產(chǎn)品的所有型號(hào)/配置���。
1. 聯(lián)合使用的特定醫(yī)用X射線設(shè)備
(1)特定醫(yī)用X射線設(shè)備的基本信息��,包括:產(chǎn)品名稱����、型號(hào)規(guī)格��、制造商��、上市信息等。
(2)特定醫(yī)用X射線設(shè)備的基本要求(例如:高壓發(fā)生器�����、濾線柵等)�,列明需要符合的相關(guān)標(biāo)準(zhǔn)�����,以及聯(lián)合使用所構(gòu)成的完整成像系統(tǒng)需要符合的相關(guān)標(biāo)準(zhǔn)����。
(3)提供不同產(chǎn)品之間連接的詳細(xì)說(shuō)明及注意事項(xiàng),并對(duì)連接操作人員進(jìn)行資質(zhì)要求和培訓(xùn)���。
2. 兒童X射線成像檢查
兒童與成人就曝光劑量���、曝光條件、造影劑用量等方面存在較大差異����,若適用,需要提供兒童檢查的詳細(xì)說(shuō)明���。
(1)兒童檢查相關(guān)產(chǎn)品設(shè)計(jì)或功能的必要說(shuō)明(例如:是否使用濾線柵)�����。建議列表描述兒童檢查適用的掃描協(xié)議��,包括協(xié)議名稱���、適用部位��、適用年齡范圍和體型����、典型成像劑量等信息�����,確保掃描參數(shù)的合理性�����。
(2)明確圖像質(zhì)量和劑量的關(guān)系�。在滿足兒童影像診斷要求的前提下,宜盡可能降低輻射劑量�。
(3)兒童檢查過(guò)程中可能出現(xiàn)的危險(xiǎn)以及相應(yīng)的緩解措施。
3. 其他
申請(qǐng)人宜刪除產(chǎn)品說(shuō)明書中未在中國(guó)注冊(cè)申報(bào)的產(chǎn)品型號(hào)規(guī)格或產(chǎn)品配置,或出具其不在擬注冊(cè)申報(bào)范圍內(nèi)的聲明��,并在產(chǎn)品說(shuō)明書中給予必要的備注���。
一、參考文獻(xiàn)
[1] 《醫(yī)療器械監(jiān)督管理?xiàng)l例》(中華人民共和國(guó)國(guó)務(wù)院令第739號(hào))[Z].
[2] 《醫(yī)療器械注冊(cè)與備案管理辦法》(國(guó)家市場(chǎng)監(jiān)督管理總局令第47號(hào))[Z].
[3] 《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》(國(guó)家藥品監(jiān)督管理局公告2021年第121號(hào))[Z].
[4] 《醫(yī)療器械注冊(cè)自檢管理規(guī)定》(國(guó)家藥品監(jiān)督管理局公告2021年第126號(hào))[Z].
[5] 《醫(yī)療器械說(shuō)明書和標(biāo)簽管理規(guī)定》(國(guó)家食品藥品監(jiān)督管理總局令第6號(hào))[Z].