醫(yī)療器械注冊質(zhì)量管理體系是什么?是YY/T0287idtISO13485嗎���?是醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范嗎���?聽過我講課的朋友們應該都清楚,醫(yī)療器械注冊質(zhì)量管理體系是YY/T0287與ISO13485,及法規(guī)要求���、客戶要求���、產(chǎn)品特點和工藝特點等的融合���。今天,從另一個視角���,為大家介紹有關醫(yī)療器械注冊體系核查的其它方面知識.
醫(yī)療器械注冊質(zhì)量管理體系是什么?是YY/T0287idtISO13485嗎���?是醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范嗎���?聽過我講課的朋友們應該都清楚,醫(yī)療器械注冊質(zhì)量管理體系是YY/T0287與ISO13485,及法規(guī)要求���、客戶要求���、產(chǎn)品特點和工藝特點等的融合。今天���,從另一個視角���,為大家介紹有關醫(yī)療器械注冊體系核查的其它方面知識.

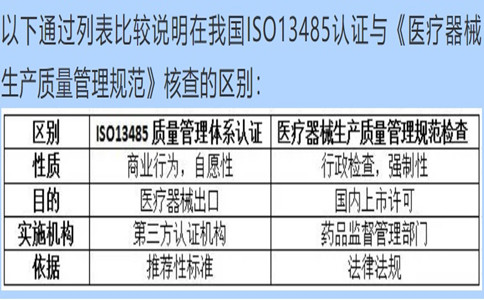
問:公司已經(jīng)通過了ISO13485的認證和年度評估���,辦理醫(yī)療器械生產(chǎn)許可時藥監(jiān)局為什么還要來進行生產(chǎn)質(zhì)量規(guī)范現(xiàn)場核查?
答:根據(jù)《醫(yī)療器械監(jiān)督管理條例》規(guī)定���,第二類���、第三類醫(yī)療器械生產(chǎn)新開辦、變更和延續(xù)均為行政許可事項���,應當向所在地省���、自治區(qū)、直轄市人民政府藥品監(jiān)督管理部門申請生產(chǎn)許可���?��!夺t(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》及附錄是醫(yī)療器械生產(chǎn)企業(yè)必須執(zhí)行的法規(guī)要求,是獲得生產(chǎn)許可的基本條件���。
ISO13485標準在國內(nèi)等同轉(zhuǎn)換為YY/T0287���,是醫(yī)療器械質(zhì)量管理體系推薦性行業(yè)標準���,實施ISO13485認證的第三方認證機構不具備行政許可資格,通過第三方認證并不能作為上市許可的必要條件���。
問:質(zhì)量部門獨立行使權力在組織架構上應如何體現(xiàn)���?有什么要求?
答:按照《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》的要求���,醫(yī)療器械生產(chǎn)企業(yè)應建立質(zhì)量管理部門,獨立行使職能���,對產(chǎn)品質(zhì)量的相關事宜負有決策的權利���。企業(yè)應成立專門的、獨立的質(zhì)量管理部門并由最高管理者或其授權代表直接管轄���。質(zhì)量管理部門應包括QA及QC的職能���,具體職能應根據(jù)企業(yè)的實際情況在其職責文件中進行明確規(guī)定,例如質(zhì)量管理、質(zhì)量控制���、質(zhì)量檢驗���、產(chǎn)品放行、讓步接收���、質(zhì)量審核���、質(zhì)量數(shù)據(jù)統(tǒng)計分析、不合格品控制���、內(nèi)部審核���、管理評審等。產(chǎn)品上市放行應由質(zhì)量受權人負責���,質(zhì)量部門應對產(chǎn)品質(zhì)量具有絕對的���、獨立的決策權,確保每批次原料���、中間品���、終產(chǎn)品符合質(zhì)量要求���。
任何有關醫(yī)療器械注冊質(zhì)量管理體系疑問,歡迎您隨時方便與杭州證標客聯(lián)絡���。