為保障江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作的順利開(kāi)展���,我局制定并發(fā)布了《江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施指南(試行)》(以下簡(jiǎn)稱(chēng)《指南》)?���,F(xiàn)依據(jù)《指南》就企業(yè)咨詢(xún)較為集中的問(wèn)題解答如下:
引言:為保障江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作的順利開(kāi)展�,我局制定并發(fā)布了《江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施指南(試行)》(以下簡(jiǎn)稱(chēng)《指南》)。現(xiàn)依據(jù)《指南》就企業(yè)咨詢(xún)較為集中的問(wèn)題解答如下:

1.參與長(zhǎng)江三角洲區(qū)域(滬蘇皖浙一市三?���。┽t(yī)療器械注冊(cè)人制度試點(diǎn)的委托范圍和受托范圍是什么?位于長(zhǎng)江三角洲區(qū)域內(nèi)的醫(yī)療器械注冊(cè)申請(qǐng)人可以委托21個(gè)試點(diǎn)省份內(nèi)具備相應(yīng)生產(chǎn)能力的企業(yè)生產(chǎn)用于醫(yī)療器械注冊(cè)型式檢驗(yàn)的樣品或批量生產(chǎn)擬上市銷(xiāo)售的醫(yī)療器械成品�����。注冊(cè)人可以委托21個(gè)試點(diǎn)省份內(nèi)符合條件的醫(yī)療器械生產(chǎn)企業(yè)生產(chǎn)已獲證產(chǎn)品��。建議醫(yī)療器械注冊(cè)申請(qǐng)人或注冊(cè)人優(yōu)先選擇長(zhǎng)江三角洲區(qū)域內(nèi)第二��、第三類(lèi)醫(yī)療器械生產(chǎn)企業(yè)進(jìn)行委托生產(chǎn)�����。位于長(zhǎng)江三角洲區(qū)域內(nèi)的符合條件的企業(yè)可以接受21個(gè)試點(diǎn)省份內(nèi)注冊(cè)申請(qǐng)人或注冊(cè)人的受托生產(chǎn)���。建議長(zhǎng)江三角洲區(qū)域內(nèi)具備條件的第二����、第三類(lèi)醫(yī)療器械生產(chǎn)企業(yè)積極參與全國(guó)試點(diǎn)范圍內(nèi)醫(yī)療器械注冊(cè)申請(qǐng)人或注冊(cè)人的受托生產(chǎn)。2.江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)的辦理流程是怎樣的���?江蘇省注冊(cè)申請(qǐng)人委托21個(gè)試點(diǎn)省份內(nèi)具備相應(yīng)生產(chǎn)能力的企業(yè)生產(chǎn)的��,首先申請(qǐng)醫(yī)療器械產(chǎn)品注冊(cè)�����,取得醫(yī)療器械注冊(cè)證��。然后受托生產(chǎn)企業(yè)辦理受托備案�����,取得受托生產(chǎn)備案憑證���。最后受托生產(chǎn)企業(yè)申請(qǐng)受托生產(chǎn)許可(開(kāi)辦)或生產(chǎn)許可變更,取得醫(yī)療器械生產(chǎn)許可證����,即可進(jìn)行委托生產(chǎn)。若注冊(cè)申請(qǐng)人與受托生產(chǎn)企業(yè)都位于江蘇省的�����,可申請(qǐng)或者變更申請(qǐng)合并檢查。具體流程如下圖1�����。
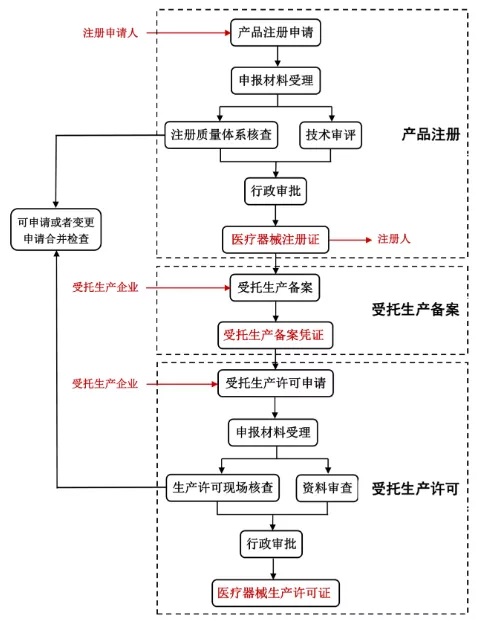
1.江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)辦理流程及申報(bào)主體
注冊(cè)人已經(jīng)獲得醫(yī)療器械注冊(cè)證并需要委托生產(chǎn)的��,受托生產(chǎn)企業(yè)首先辦理受托備案�����,取得受托生產(chǎn)備案憑證���。然后受托生產(chǎn)企業(yè)申請(qǐng)受托生產(chǎn)許可(開(kāi)辦)或生產(chǎn)許可變更,取得醫(yī)療器械生產(chǎn)許可證���。最后�����,注冊(cè)人申請(qǐng)醫(yī)療器械注冊(cè)證登記事項(xiàng)變更���,取得醫(yī)療器械注冊(cè)證變更文件。具體如下圖2�。
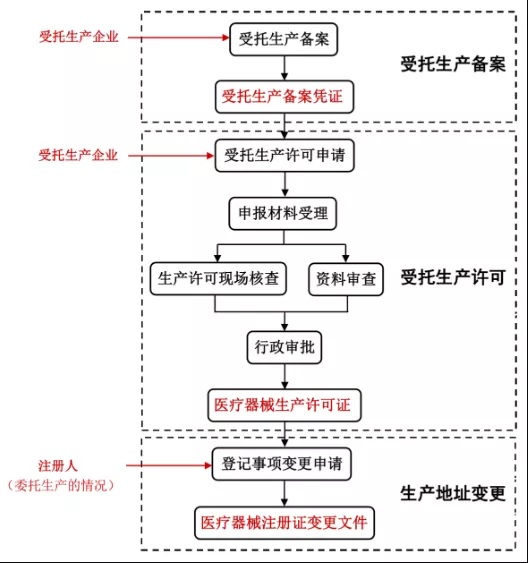
圖2.江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)辦理流程及申報(bào)主體關(guān)于產(chǎn)品注冊(cè)、生產(chǎn)許可的申報(bào)要求可以在省局網(wǎng)站政務(wù)服務(wù)——辦事指南欄目中查看,具體網(wǎng)址如下:http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/fr_index.do?webId=1&themid=&deptid=320000SY#fw_jump不同許可事項(xiàng)申請(qǐng)表已經(jīng)上傳更新版本��,需要提交材料的請(qǐng)至網(wǎng)站下載并使用最新版本��,以下提供部分許可事項(xiàng)辦理流程和辦理材料要求的網(wǎng)址:江蘇省第二類(lèi)醫(yī)療器械擬上市產(chǎn)品注冊(cè)http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webId=1&iddept_yw_inf=7bff9c5195e9433e8382769aa183947a&ql_kind=01&iddept_ql_inf=433&iszx=江蘇省第二類(lèi)體外診斷試劑擬上市產(chǎn)品注冊(cè)http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webId=1&iddept_yw_inf=5abdda919be0429994efa59d4a79488a&ql_kind=01&iddept_ql_inf=433&iszx=開(kāi)辦第二��、三類(lèi)醫(yī)療器械生產(chǎn)企業(yè)http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webId=1&iddept_yw_inf=6948a9afa8e344edb41d69331fae7243&ql_kind=01&iddept_ql_inf=434&iszx=醫(yī)療器械生產(chǎn)許可證許可事項(xiàng)變更http://www.jszwfw.gov.cn/jszwfw/bscx/itemlist/bszn.do?webId=1&iddept_yw_inf=ca142901abe340a290b130f4f0a125c7&ql_kind=01&iddept_ql_inf=434&iszx=3.制度試點(diǎn)實(shí)施允許委托生產(chǎn)產(chǎn)品范圍包括哪些�?制度試點(diǎn)實(shí)施允許委托生產(chǎn)產(chǎn)品范圍包括第二類(lèi)、三類(lèi)醫(yī)療器械�����;屬于原國(guó)家食品藥品監(jiān)督管理總局發(fā)布的禁止委托生產(chǎn)醫(yī)療器械目錄的產(chǎn)品��,原則上不列入試點(diǎn)范圍���。值得注意的是����,第一類(lèi)醫(yī)療器械不包含在試點(diǎn)范圍內(nèi)��。4.注冊(cè)申請(qǐng)人委托生產(chǎn)的��,申報(bào)第二類(lèi)醫(yī)療器械注冊(cè)時(shí)���,除符合《國(guó)家食品藥品監(jiān)督管理總局關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告(2014年第43號(hào))》或《國(guó)家食品藥品監(jiān)督管理總局關(guān)于公布體外診斷試劑注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告(2014年第44號(hào))》等要求外��,還需要根據(jù)《江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施指南(試行)》提交哪些資料(見(jiàn)《指南》第四條)�����?(1)受托生產(chǎn)企業(yè)的營(yíng)業(yè)執(zhí)照復(fù)印件�����;(2)注冊(cè)申請(qǐng)人的質(zhì)量管理能力自查報(bào)告�;(3)委托生產(chǎn)合同復(fù)印件(明確雙方合作生產(chǎn)方式���,委托方和受托方的權(quán)利���、義務(wù)與責(zé)任,產(chǎn)品驗(yàn)收標(biāo)準(zhǔn)���,產(chǎn)品損害賠償�,合同終止條件等)�;(4)現(xiàn)場(chǎng)考核評(píng)估報(bào)告(注冊(cè)申請(qǐng)人對(duì)受托生產(chǎn)企業(yè)的生產(chǎn)條件、技術(shù)水平�����、質(zhì)量管理情況進(jìn)行現(xiàn)場(chǎng)考核評(píng)估,闡述該受托企業(yè)與所合作品種的匹配性��,以及合作關(guān)系確立后的定期審核計(jì)劃)�;(5)委托生產(chǎn)質(zhì)量協(xié)議復(fù)印件(明確委托生產(chǎn)的范圍,雙方在產(chǎn)品質(zhì)量實(shí)現(xiàn)的全過(guò)程中各自的質(zhì)量安全責(zé)任��、權(quán)利和義務(wù)�,質(zhì)量管理體系的要求,產(chǎn)品的性能�、生產(chǎn)、質(zhì)控要求���,委托生產(chǎn)的變更控制與審批�,雙方發(fā)生分歧的解決等)��;(6)知識(shí)產(chǎn)權(quán)保護(hù)協(xié)議復(fù)印件(明確雙方在知識(shí)產(chǎn)權(quán)保護(hù)方面各自的的責(zé)任���、權(quán)利和義務(wù))��;(7)轉(zhuǎn)移文件清單(例如技術(shù)要求�、生產(chǎn)工藝��、原材料要求、說(shuō)明書(shū)和標(biāo)簽等技術(shù)文件已有效轉(zhuǎn)移給擬受托生產(chǎn)企業(yè)�,并形成文件清單)。5.符合條件的集團(tuán)公司向省局辦理內(nèi)部醫(yī)療器械注冊(cè)人變更的����,需要根據(jù)《江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施指南(試行)》提交哪些資料(見(jiàn)《指南》第七條)?(1)雙方隸屬于同一集團(tuán)公司的股權(quán)證明復(fù)印件��;(2)轉(zhuǎn)移文件清單(例如技術(shù)要求���、生產(chǎn)工藝�、原材料要求���、說(shuō)明書(shū)和標(biāo)簽等技術(shù)文件已有效轉(zhuǎn)移給擬受托生產(chǎn)企業(yè),并形成文件清單)���;(3)明確變更前已上市產(chǎn)品質(zhì)量責(zé)任主體的協(xié)議/合同復(fù)印件��;(4)承諾生產(chǎn)地址��、生產(chǎn)條件和技術(shù)要求等生產(chǎn)要素不發(fā)生改變的保證聲明�����;(5)對(duì)變更過(guò)程及變更后果承擔(dān)法律責(zé)任的保證聲明���,以及與集團(tuán)總公司簽訂的擔(dān)保協(xié)議復(fù)印件��;(6)43號(hào)公告或44號(hào)公告中登記事項(xiàng)變更要求的其他資料���。以上(1)至(5)資料均需變更雙方同時(shí)簽章。符合要求的�,省局參照登記事項(xiàng)變更程序辦理。6.注冊(cè)人委托生產(chǎn)的�,受托生產(chǎn)企業(yè)需向省局辦理受托生產(chǎn)備案,備案時(shí)應(yīng)當(dāng)根據(jù)《江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施指南(試行)》提交哪些資料(見(jiàn)《指南》第十條)����?(1)醫(yī)療器械受托生產(chǎn)備案表;(2)受托生產(chǎn)的《醫(yī)療器械注冊(cè)證》復(fù)印件���;(3)注冊(cè)人的營(yíng)業(yè)執(zhí)照復(fù)印件����;(4)受托生產(chǎn)企業(yè)的營(yíng)業(yè)執(zhí)照復(fù)印件��;(5)委托生產(chǎn)合同��;(6)委托生產(chǎn)質(zhì)量協(xié)議復(fù)印件;(7)受托生產(chǎn)企業(yè)的《醫(yī)療器械生產(chǎn)許可證》復(fù)印件(如有)���;(8)受托生產(chǎn)企業(yè)具備相應(yīng)生產(chǎn)能力的證明材料(例如受托生產(chǎn)企業(yè)質(zhì)量管理體系情況證明文件)����;(9)經(jīng)辦人授權(quán)證明����。我局負(fù)責(zé)對(duì)提交的資料進(jìn)行審核,評(píng)估受托生產(chǎn)企業(yè)是否具備受托生產(chǎn)條件�,比如受托生產(chǎn)企業(yè)的人員管理、生產(chǎn)廠房�、設(shè)施設(shè)備是否與受托生產(chǎn)產(chǎn)品的生產(chǎn)規(guī)模和品種等相匹配。7.受托生產(chǎn)企業(yè)向省局申請(qǐng)受托生產(chǎn)許可或生產(chǎn)許可變更的�,除應(yīng)當(dāng)符合省局對(duì)二、三類(lèi)醫(yī)療器械生產(chǎn)許可申報(bào)資料的要求外�����,還需要根據(jù)《江蘇省醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施指南(試行)》提交哪些資料(見(jiàn)《指南》第十一條)���?(1)注冊(cè)人營(yíng)業(yè)執(zhí)照復(fù)印件;(2)受托生產(chǎn)產(chǎn)品的《醫(yī)療器械注冊(cè)證》復(fù)印件;(3)受托生產(chǎn)產(chǎn)品的產(chǎn)品技術(shù)要求復(fù)印件��;(4)受托生產(chǎn)產(chǎn)品擬采用的說(shuō)明書(shū)和標(biāo)簽樣稿;(5)《受托生產(chǎn)備案憑證》復(fù)印件�����;(6)委托生產(chǎn)合同復(fù)印件��;(7)委托生產(chǎn)質(zhì)量協(xié)議復(fù)印件����;(8)知識(shí)產(chǎn)權(quán)保護(hù)協(xié)議復(fù)印件。8.注冊(cè)申請(qǐng)人委托生產(chǎn)的���,注冊(cè)質(zhì)量管理體系核查范圍還包括哪些方面?注冊(cè)申請(qǐng)人委托生產(chǎn)的����,原則上應(yīng)當(dāng)對(duì)注冊(cè)申請(qǐng)人及受托生產(chǎn)企業(yè)的質(zhì)量管理體系同步進(jìn)行現(xiàn)場(chǎng)核查�。注冊(cè)質(zhì)量管理體系核查范圍還包含以下幾種情況:(1)同一注冊(cè)申請(qǐng)人委托多家企業(yè)生產(chǎn)的,應(yīng)當(dāng)對(duì)注冊(cè)申請(qǐng)人以及相關(guān)受托生產(chǎn)企業(yè)進(jìn)行現(xiàn)場(chǎng)核查�;(2)注冊(cè)申請(qǐng)人僅為樣品研發(fā)主體,生產(chǎn)工藝建立和驗(yàn)證����、設(shè)計(jì)轉(zhuǎn)換均在受托生產(chǎn)企業(yè)完成的,應(yīng)當(dāng)對(duì)注冊(cè)申請(qǐng)人研發(fā)地址和受托企業(yè)生產(chǎn)地址進(jìn)行同步核查;(3)注冊(cè)申請(qǐng)人委托外部機(jī)構(gòu)進(jìn)行設(shè)計(jì)開(kāi)發(fā)的���,注冊(cè)體系核查可以根據(jù)情況對(duì)受托研發(fā)企業(yè)進(jìn)行延伸核查��。(4)根據(jù)受托生產(chǎn)企業(yè)情況對(duì)關(guān)鍵物料或者關(guān)鍵工序/特殊過(guò)程的供應(yīng)商進(jìn)行延伸核查�。(5)注冊(cè)申請(qǐng)人委托本省內(nèi)企業(yè)生產(chǎn)的��,注冊(cè)質(zhì)量管理體系現(xiàn)場(chǎng)核查可與生產(chǎn)許可申請(qǐng)或者變更申請(qǐng)合并檢查���。9. 注冊(cè)申請(qǐng)人委托生產(chǎn)的�,注冊(cè)質(zhì)量管理體系核查除需按照《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》要求外�����,還需重點(diǎn)關(guān)注哪些方面���?對(duì)于參與試點(diǎn)的醫(yī)療器械注冊(cè)申請(qǐng)人和受托生產(chǎn)企業(yè)在體系核查重點(diǎn)上與原來(lái)有所區(qū)別:(1)注冊(cè)申請(qǐng)人具備承擔(dān)醫(yī)療器械質(zhì)量安全責(zé)任的能力���;(2)注冊(cè)申請(qǐng)人對(duì)受托生產(chǎn)企業(yè)進(jìn)行質(zhì)量管理體系評(píng)估、審核和監(jiān)督的能力��;(3)注冊(cè)申請(qǐng)人對(duì)委托生產(chǎn)產(chǎn)品的技術(shù)文件��、生產(chǎn)工藝���、設(shè)計(jì)變更等有效轉(zhuǎn)移情況��;(4)注冊(cè)申請(qǐng)人所選擇的受托生產(chǎn)企業(yè)具有持續(xù)穩(wěn)定生產(chǎn)合格受托產(chǎn)品的能力���。10.注冊(cè)人委托生產(chǎn)的,生產(chǎn)許可現(xiàn)場(chǎng)核查除需按照《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》要求外���,還需重點(diǎn)關(guān)注哪些方面?對(duì)于參與試點(diǎn)的受托生產(chǎn)企業(yè)在現(xiàn)場(chǎng)核查重點(diǎn)上與原來(lái)有所區(qū)別:(1)受托生產(chǎn)企業(yè)應(yīng)當(dāng)具備與擬生產(chǎn)醫(yī)療器械相適應(yīng)的質(zhì)量管理體系及相應(yīng)人員配備和管理經(jīng)驗(yàn)���;(2)受托生產(chǎn)企業(yè)應(yīng)當(dāng)具備與產(chǎn)品相適應(yīng)的生產(chǎn)廠房、設(shè)備設(shè)施��、質(zhì)量檢驗(yàn)設(shè)施及同類(lèi)產(chǎn)品生產(chǎn)經(jīng)驗(yàn)等��;(3)受托生產(chǎn)企業(yè)對(duì)受托品種生產(chǎn)工藝流程�����、原材料要求等的理解和控制情況��;(4)受托生產(chǎn)企業(yè)對(duì)共線(xiàn)生產(chǎn)的可行性評(píng)估和執(zhí)行情況(受托產(chǎn)品與原有產(chǎn)品為共線(xiàn)生產(chǎn)的情況適用)����;(5)受托生產(chǎn)企業(yè)是否具備接受多個(gè)注冊(cè)人委托生產(chǎn)的能力(同時(shí)接受多個(gè)注冊(cè)人委托生產(chǎn)的情況適用)���。